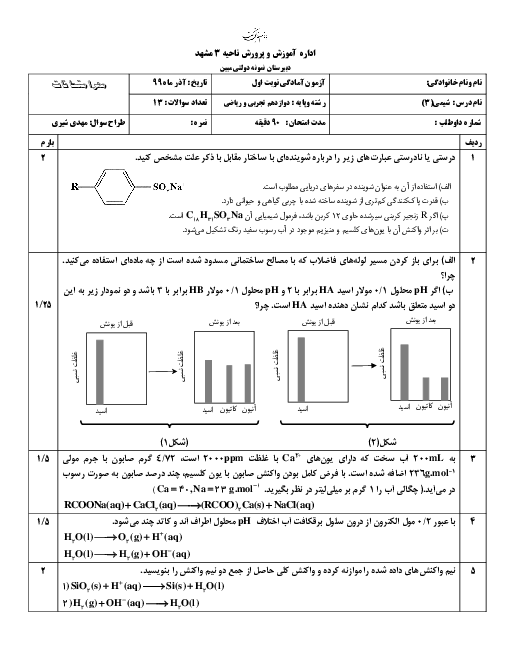
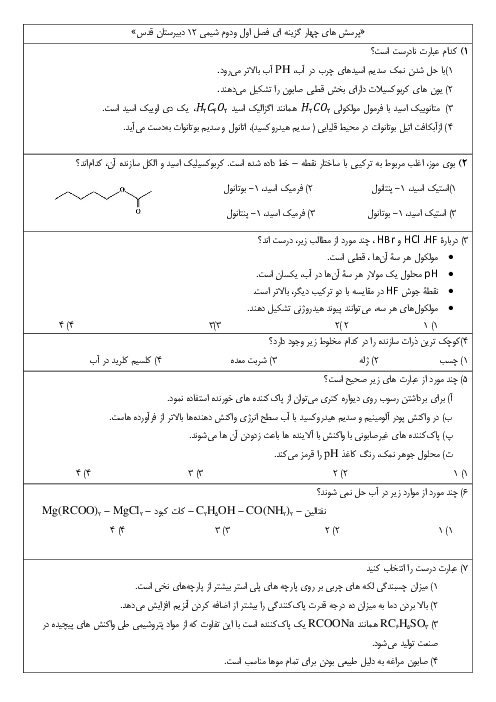
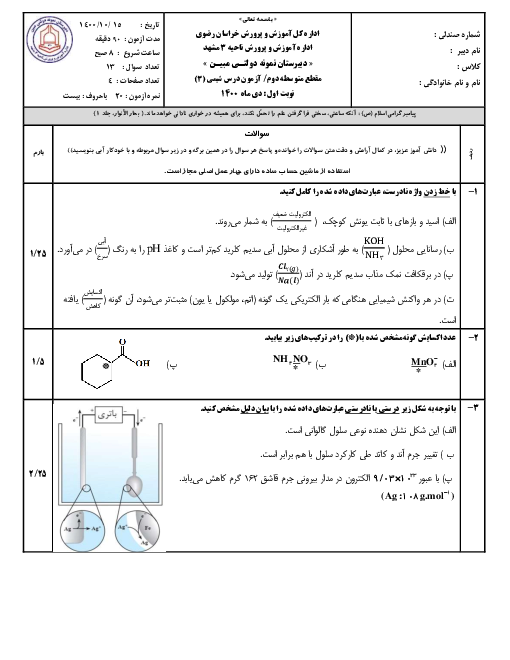
آیا مقدار عددی پی اچ میتواند منفی باشد؟ آیا گسترهٔ pH همیشه 0 تا 14 است؟ پاسخ کوتاه: در دمای 25 درجه و در محلولهای آبی رقیق (شرایطی که ما در دبیرستان و کنکور بررسی میکنیم) بله، تقریباً همیشه بین 0 تا 14 است. اما در شرایط خاص میتواند منفی شود یا از 14 بیشتر شود! چرا در کتاب میگویند 0 تا 14؟ چون ثابت یونش آب در 25 درجه سانتیگراد این مقدار است: Kw = [H₃O⁺][OH⁻] = 1 × 10⁻¹⁴ در آب خالص: [H₃O⁺] = [OH⁻] = 10⁻⁷ → pH = 7 قویترین اسید ممکن در آب رقیق: تقریباً [H₃O⁺] ≈ 1 mol/L → pH ≈ 0 قویترین باز ممکن در آب رقیق: تقریباً [OH⁻] ≈ 1 mol/L → pOH ≈ 0 → pH ≈ 14 پس در شرایط عادی و محلولهای رقیق آبی، pH از 0 تا 14 تغییر میکند. حالا سؤالات کنکوری و کنجکاویبرانگیز: 1. آیا pH میتواند منفی باشد؟ بله! اگر غلظت H₃O⁺ بیشتر از 1 mol/L باشد. مثال: اسید کلریدریک 12 مولار (غلیظ): [H₃O⁺] ≈ 12 mol/L → pH ≈ −1٫1 اسید سولفوریک 18 مولار: pH ≈ −1٫7 این اسیدها در صنعت و آزمایشگاه واقعی وجود دارند و pH منفی دارند. 2. آیا pH میتواند بیشتر از 14 باشد؟ بله! اگر غلظت OH⁻ بیشتر از 1 mol/L باشد. مثال: سود 10 مولار: [OH⁻] ≈ 10 → pOH ≈ −1 → pH ≈ 15 در آزمایشگاههای واقعی این اتفاق میافتد. 3. پس چرا در دبیرستان میگوییم 0 تا 14؟ چون: تقریباً همهٔ محلولهایی که ما میسازیم رقیق هستند (کمتر از 1 مولار) در کنکور و امتحان نهایی تقریباً همیشه فرض میکنند محلول رقیق است اثر «یونی یکسان» و فعالیت (activity) را در نظر نمیگیرند 4. نکتهٔ خیلی مهم برای تعادل یونی و اصل لوشاتلیه اگر شما یک اسید خیلی غلیظ (مثلاً HCl 10 M) را در آب بریزید: در ابتدا [H₃O⁺] خیلی بالاست → pH منفی اما به محض رقیق شدن با آب، تعادل خودیونش آب به چپ میرود (اصل لوشاتلیه) و [H₃O⁺] کم میشود و pH بالا میرود.
آیا مقدار پیاچ منفی است؟
پاسخ ها: {{ repliesNum }}
پاسخ انتخاب شده
در پاسخ به: {{ reply.reply_to.name }}
در پاسخ به
این پیام حذف شده است.