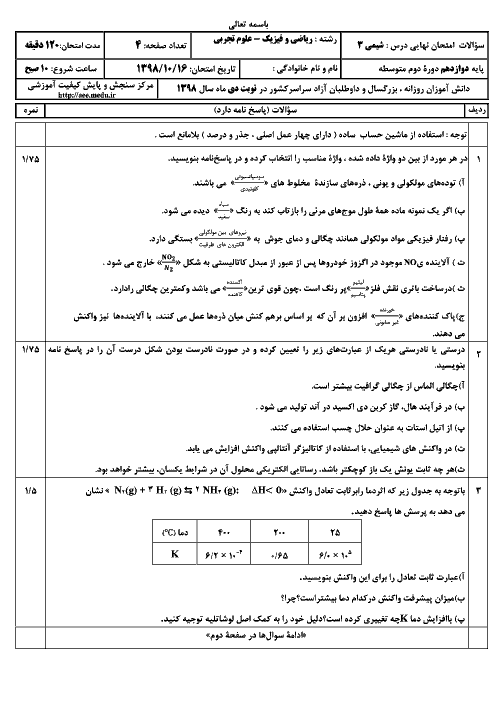
ثابت تعادل در واکنش تعادلی (g)N2O4(g)=2NO2 اگر در دما معین برابر 0/2 است اگر در یک ظرف 0/5 لیتری 0/2 مول NO2 و 0/1 مول N2O4 با هم مخلوط کنیم چند عبارت درست است؟ 1)واکنش در تعادل است. 2)واکنش درجهت مصرف N2O4 است. 3)واکنش با مصرف کمتر از 0/1 مول NO2 به تعادل می رسد. 4)واکنش با تولید بیش از 0/05 مول N2O4 به تعادل می رسد.
ثابت تعادل و رفتار واکنش در شیمی دوازدهم
پاسخ ها: {{ repliesNum }}
پاسخ انتخاب شده
در پاسخ به: {{ reply.reply_to.name }}
در پاسخ به
این پیام حذف شده است.