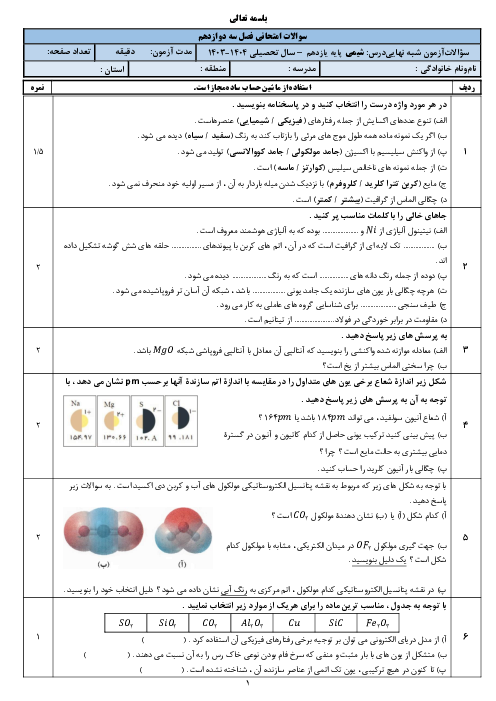
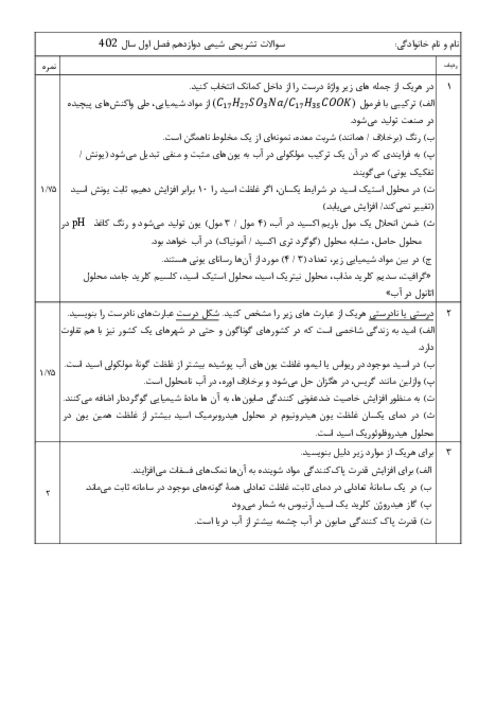
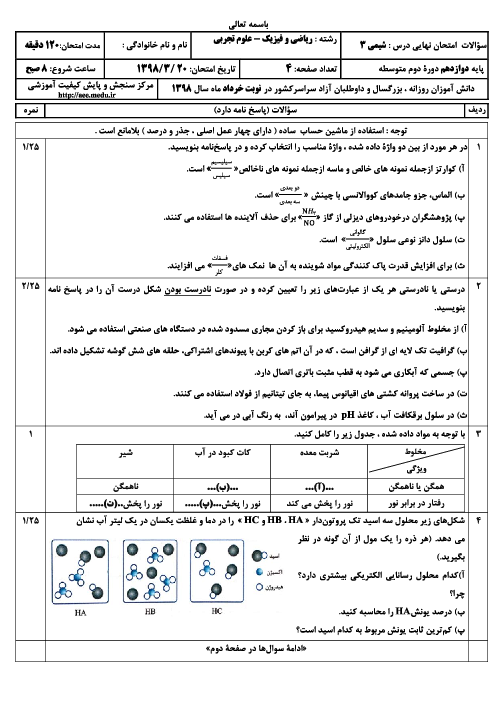
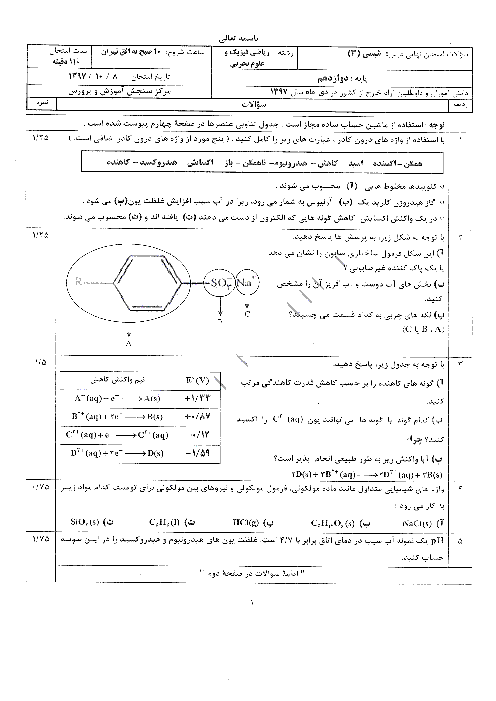
در یک ظرف واکنش N2+H2=NH3 به تعادل رسیده است اگر سرعتسنج سرعت واکنش رفت را m نشان بدهد کدام مطلب درست است؟ 1)m برابر صفر است 2)اگر افزایش فشار سرعت واکنش برگشت 4m شود سرعت واکنش رفت 8m می شود 3)اگر افزایش دما سرعت واکنش برگشت 1/5m شود سرعت واکنش رفت برابر 1/5m است 4)اگر مقداری آمونیاک از ظرف خارج کنیم سرعت واکنش رفت بیشتر از m شده و سرعت واکنش برگشت کمتر m می شود
سرعت واکنش در تعادل شیمیایی در دوازدهم
پاسخ ها: {{ repliesNum }}
پاسخ انتخاب شده
در پاسخ به: {{ reply.reply_to.name }}
در پاسخ به
این پیام حذف شده است.