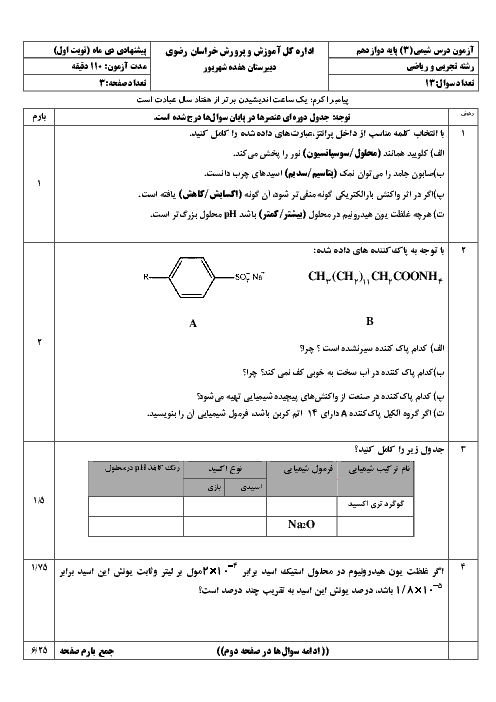
پاسخ تشریحی: ابتدا، از رابطه تعادل یونش آمونیاک استفاده میکنیم: NH 3 + H 2 O ⇌ NH 4 + + OH − NH 3 +H 2 O⇌NH 4 + +OH − ثابت یونش ( 𝐾 𝑏 K b ) به صورت زیر تعریف میشود: 𝐾 𝑏 = [ NH 4 + ] [ OH − ] [ NH 3 ] K b = [NH 3 ] [NH 4 + ][OH − ] با فرض اینکه غلظتهای [ NH 4 + ] [NH 4 + ] و [ OH − ] [OH − ] برابر با 𝑥 x هستند و [ NH 3 ] [NH 3 ] برابر با 0.1 − 𝑥 0.1−x است: 𝐾 𝑏 = 𝑥 2 0.1 − 𝑥 K b = 0.1−x x 2 با فرض 𝑥 x کوچکتر از 0.1، میتوانیم بنویسیم: 𝐾 𝑏 ≈ 𝑥 2 0.1 K b ≈ 0.1 x 2 𝑥 2 = 𝐾 𝑏 × 0.1 = 1.8 × 1 0 − 5 × 0.1 = 1.8 × 1 0 − 6 x 2 =K b ×0.1=1.8×10 −5 ×0.1=1.8×10 −6 𝑥 = 1.8 × 1 0 − 6 = 1.34 × 1 0 − 3 x= 1.8×10 −6 =1.34×10 −3 بنابراین، غلظت یون هیدروکسید ( [ OH − ] [OH − ]) برابر با 1.34 × 1 0 − 3 مولار 1.34×10 −3 مولار است.
فرض کنید در یک محلول 0.1 مولار آمونیاک (NH 3 NH 3) با ? ? = 1.8 × 1 0 − 5 K b =1.8×10 −5، مقدار pH را محاسبه کنید.
پاسخ ها: {{ repliesNum }}
پاسخ انتخاب شده
در پاسخ به: {{ reply.reply_to.name }}
در پاسخ به
این پیام حذف شده است.