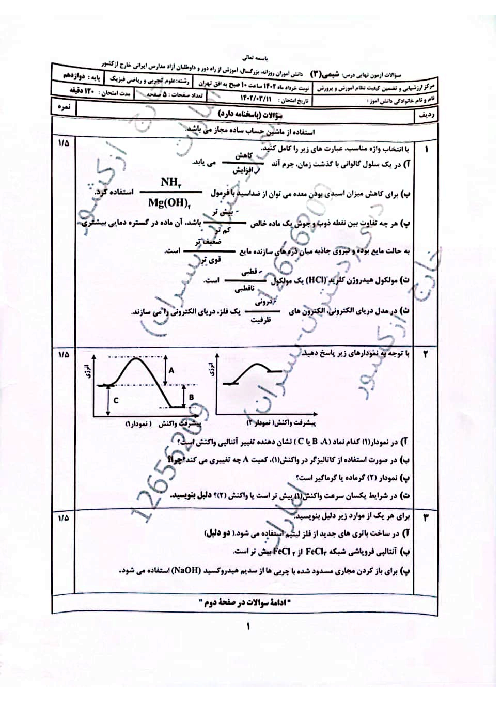
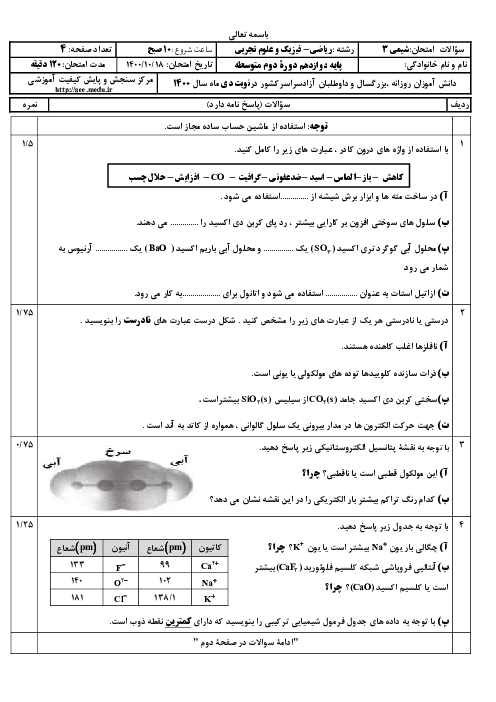
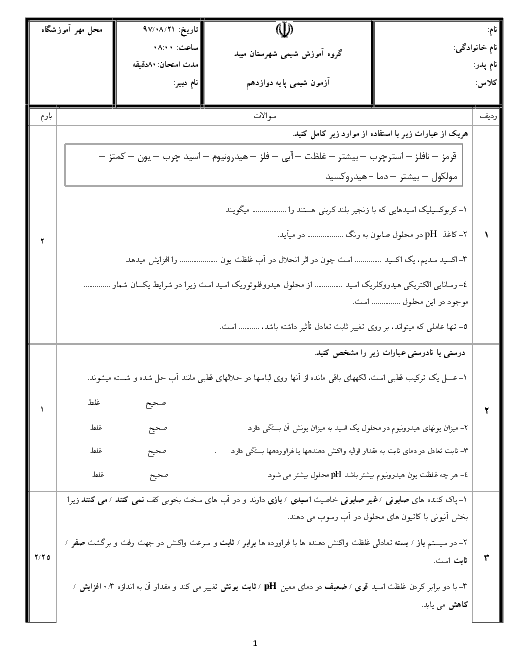
0.365 گرم هیدروکلریک اسید را در آب حل کرده و حجم محلول را به 500 میلی لیتر می رسانیم، پی اچ محلول مورد نظر را حساب کنید؟
PH یک نمونه از آب سیب برابر 4.7 است، نسبت غلظت یونهای هیدرونیوم به یونهای هیدروکسید در این نمونه را حساب کنید.
پاسخ ها: {{ repliesNum }}
پاسخ انتخاب شده
در پاسخ به: {{ reply.reply_to.name }}
در پاسخ به
این پیام حذف شده است.