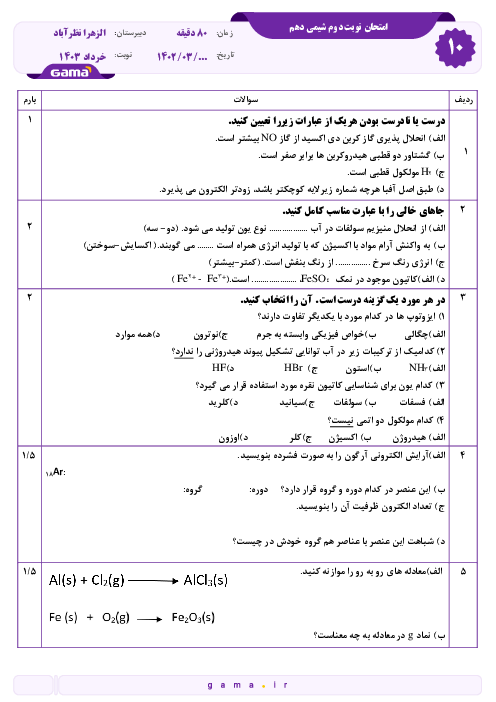
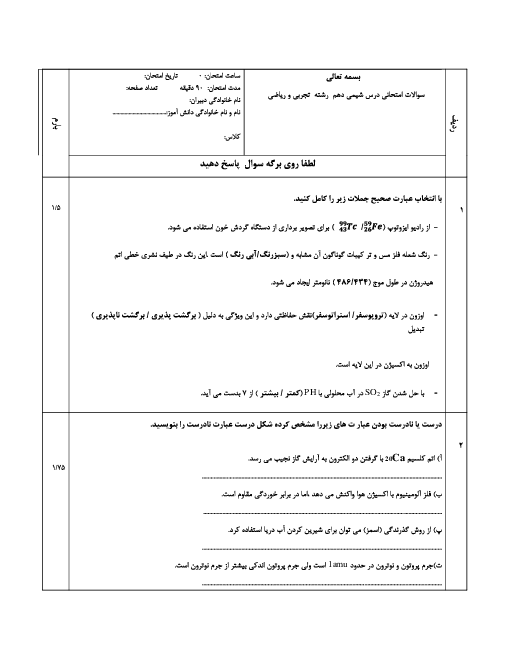
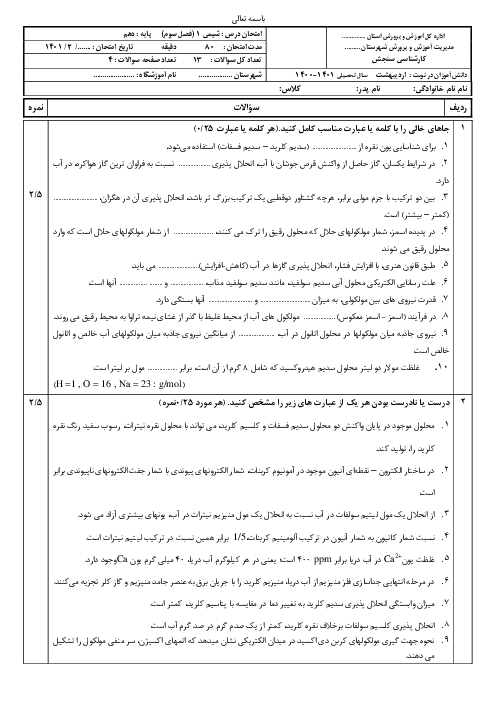
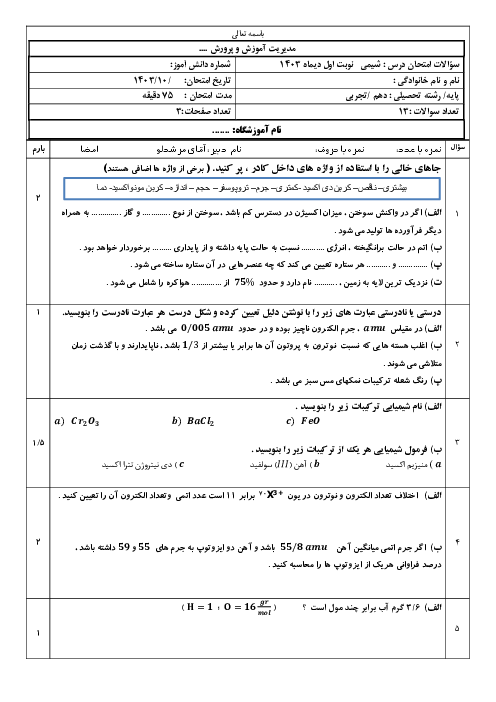
هر چقدر n لایه ها بیشتر بشه لایه ها در لایه های دورتر در فاصله های نزدیکتری نسبت به هم قرار میگیرن طبق تصویر 22 ص 27 اما موقعیت زیرلایه ها چطور خواهد بود نسبت بهم؟
موقعیت زیرلایهها چطور خواهد بود نسبت بهم؟
پاسخ ها: {{ repliesNum }}
پاسخ انتخاب شده
در پاسخ به: {{ reply.reply_to.name }}
در پاسخ به
این پیام حذف شده است.