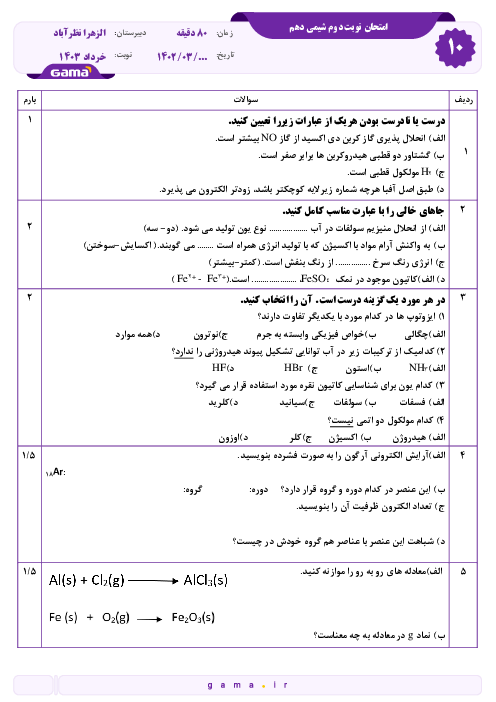
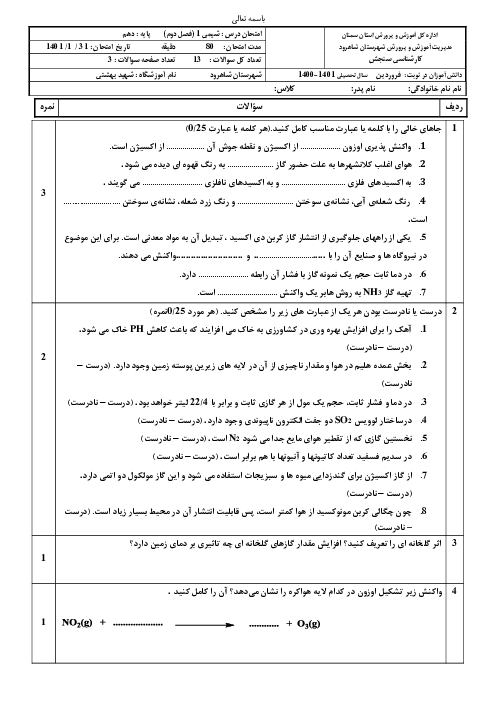
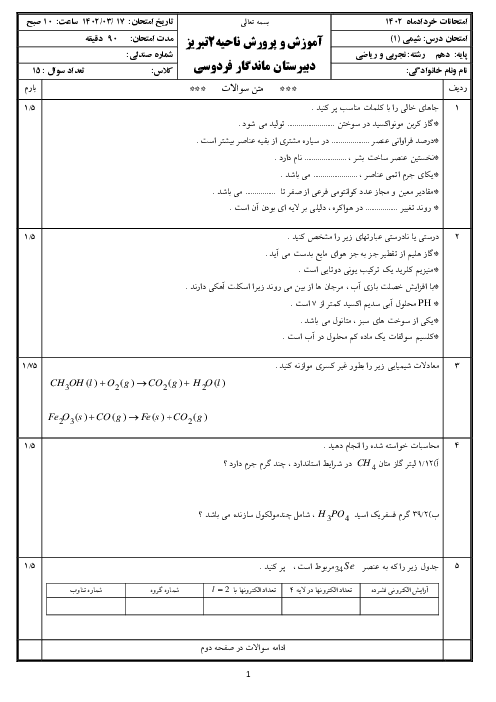
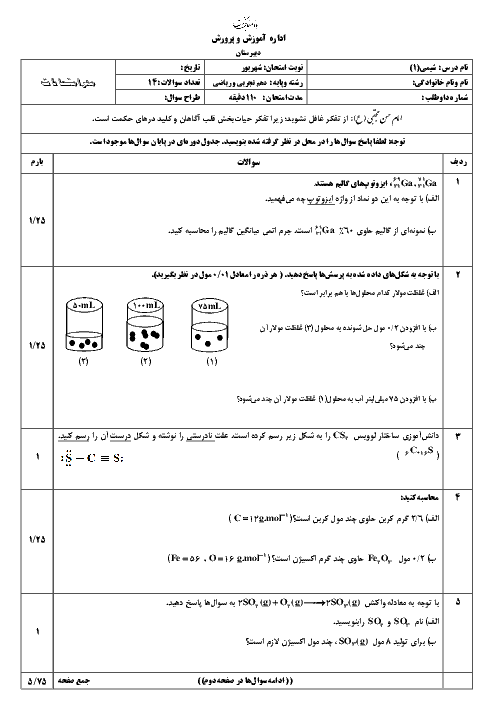
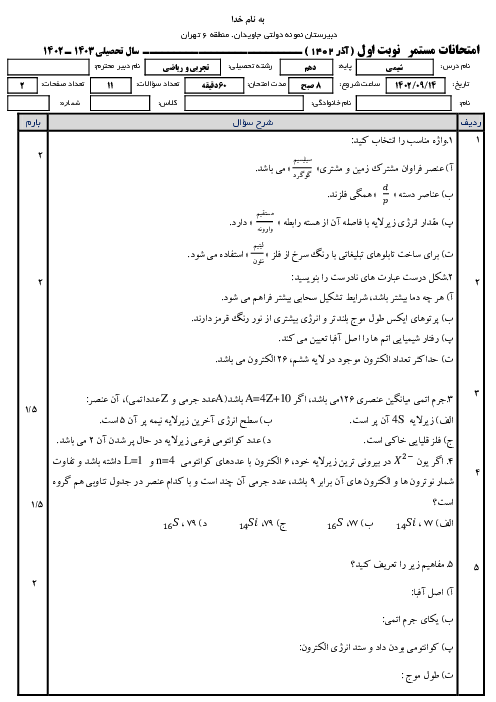
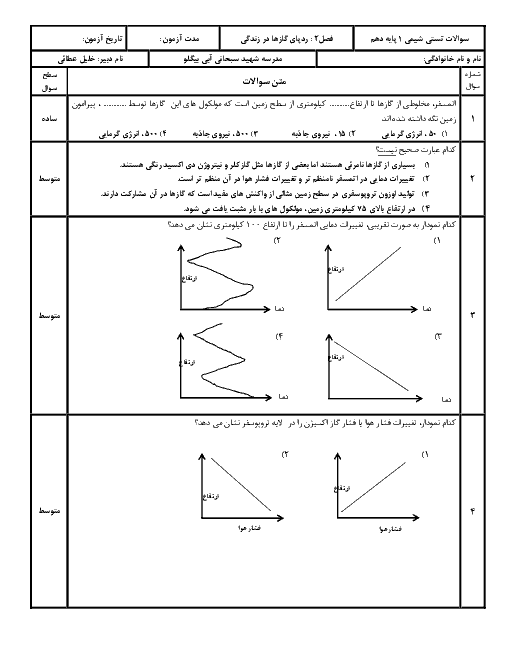
چطور ساختار لوویس رو رسم کنیم؟ برای رسمش چه اطلاعاتی لازمه
جدیدترین پاسخها
بهترین پاسخها
![]()
پاسخ ها: {{ repliesNum }}
پاسخ انتخاب شده
در پاسخ به: {{ reply.reply_to.name }}
در پاسخ به
این پیام حذف شده است.