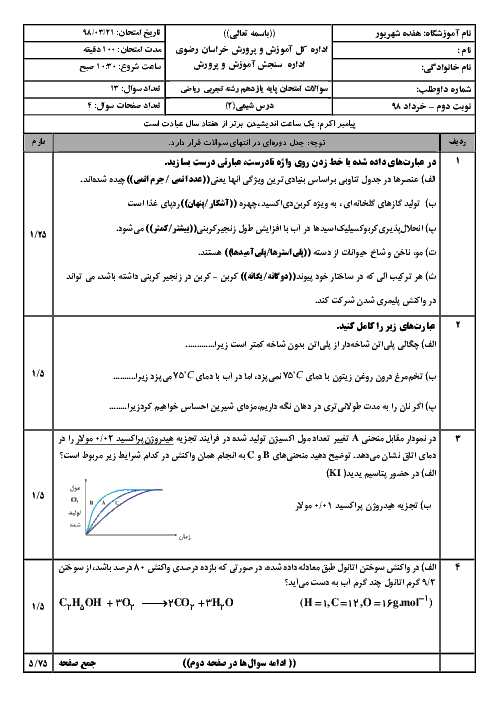
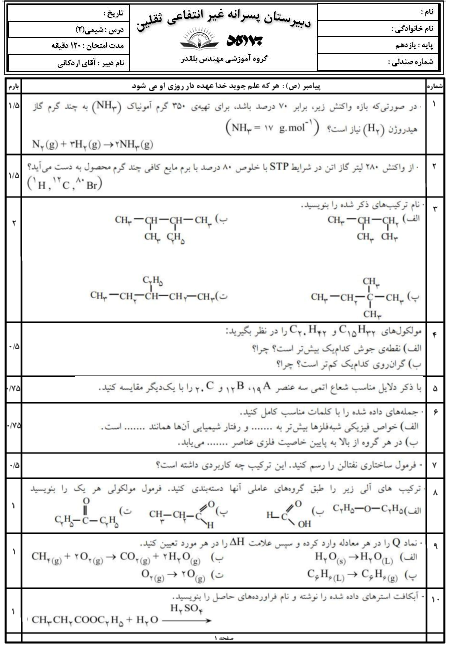
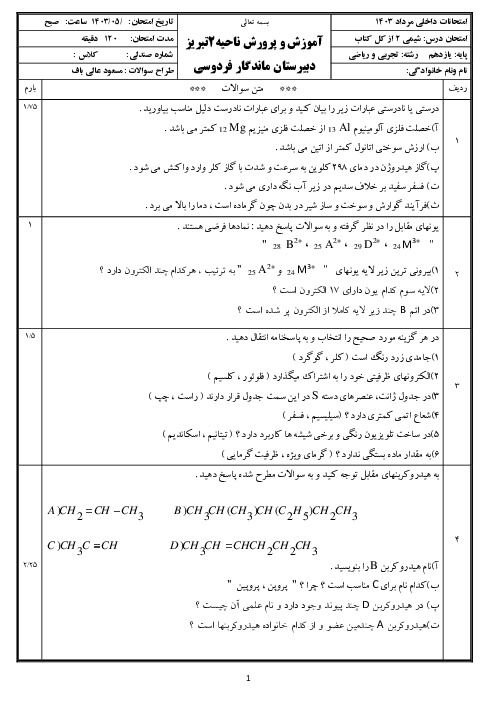
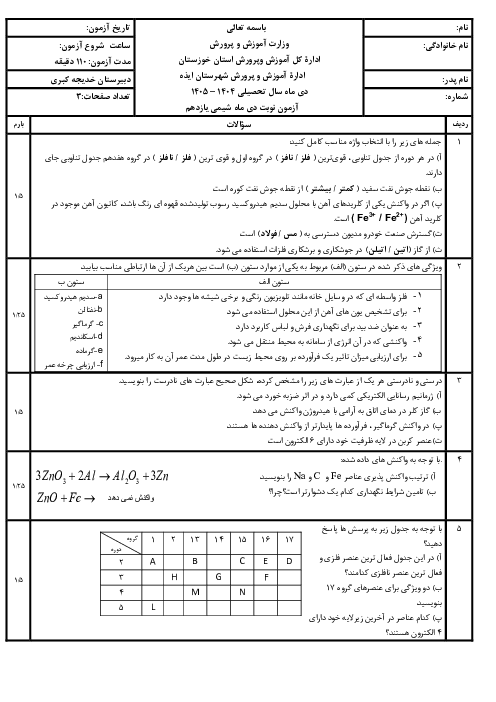
چرا عنصر های گروه 14 جدول تناوبی یون نمیشوند
چرا عنصرهای گروه 14 جدول تناوبی یون نمیشوند؟
پاسخ ها: {{ repliesNum }}
پاسخ انتخاب شده
در پاسخ به: {{ reply.reply_to.name }}
در پاسخ به
این پیام حذف شده است.