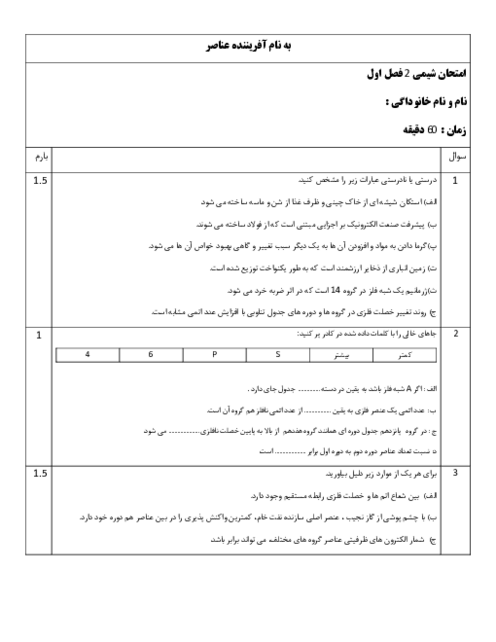
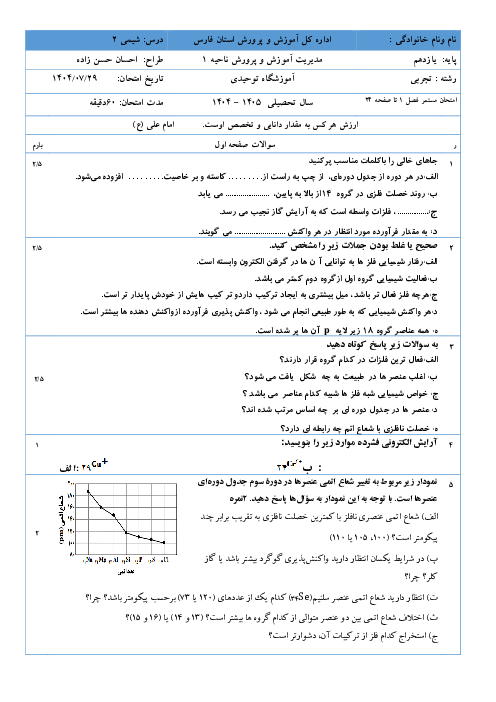
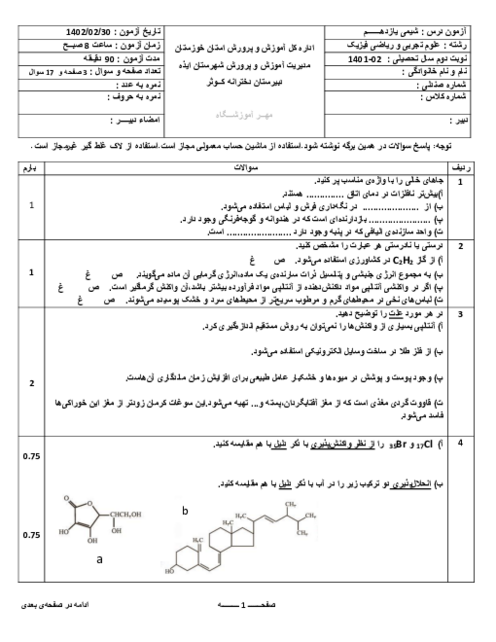
(g)C6H12O6(aq)→2C2H5OH(aq)+2CO2
در واکنش تهیه سوخت سبز اتانول، از تخمیر 540kg گلوکز مقدار 207kg اتانول به دست آمده است. بازده درصدی واکنش چند است؟
پاسخ ها: {{ repliesNum }}
پاسخ انتخاب شده
در پاسخ به: {{ reply.reply_to.name }}
در پاسخ به
این پیام حذف شده است.