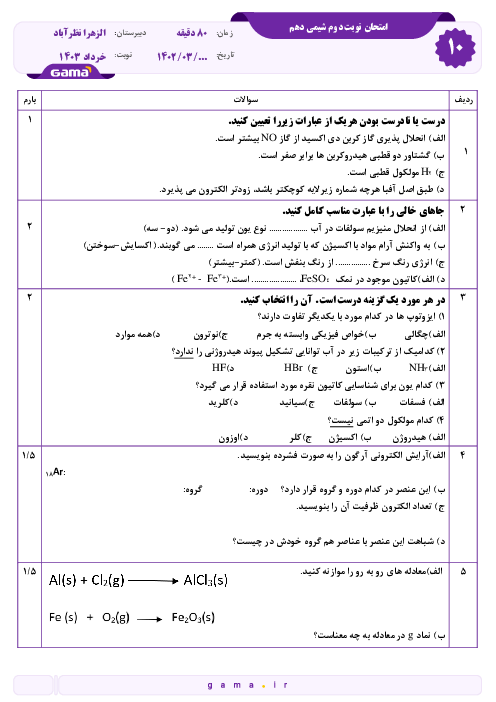
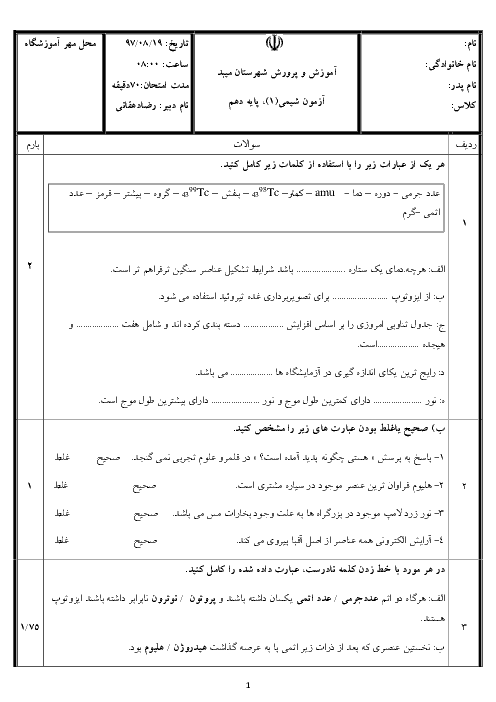
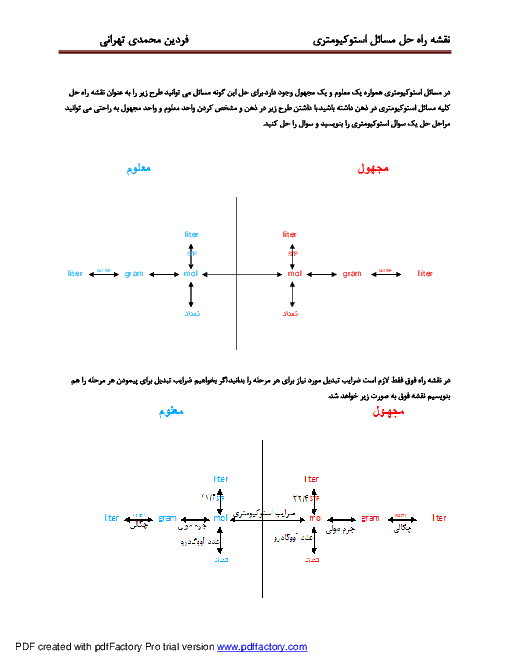
در 9 گرم یون آمونیم در مجموع چه تعداد ذره زیر اتمی وجود دارد؟
منظور این سوال از ذره زیر اتمی چیست؟
پاسخ ها: {{ repliesNum }}
پاسخ انتخاب شده
در پاسخ به: {{ reply.reply_to.name }}
در پاسخ به
این پیام حذف شده است.