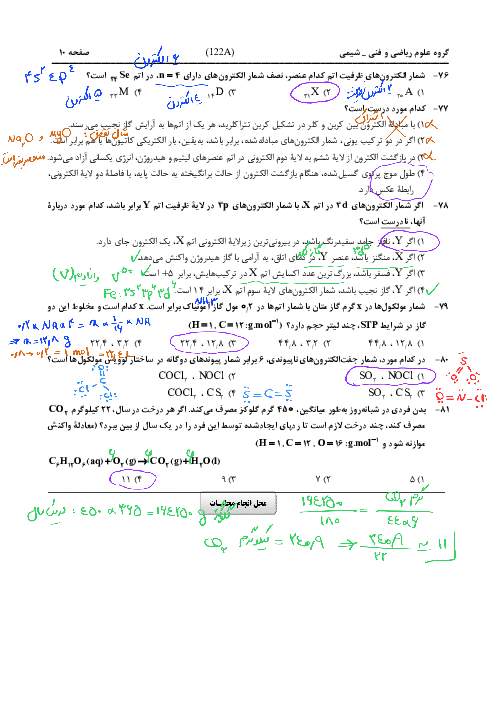
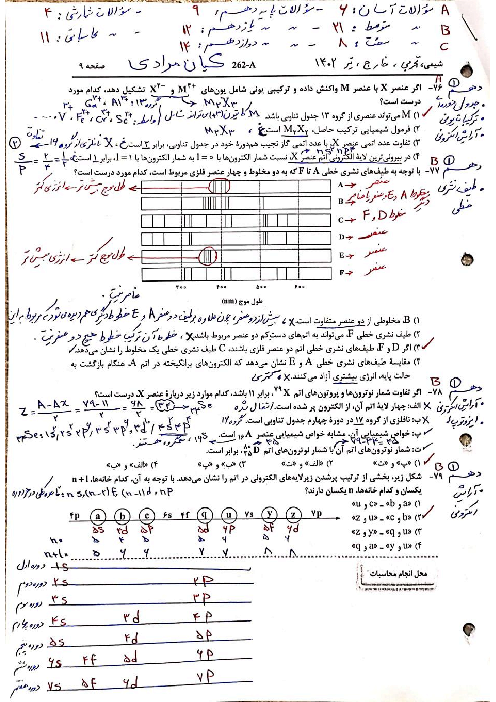
چجوری بفهمیم بار کاتیون یا انیون چنده مثلا mg دو بار مثبت هست ؟
چجوری بفهمیم بار کاتیون یا آنیون چند است مثلا mg دو بار مثبت است؟
پاسخ ها: {{ repliesNum }}
پاسخ انتخاب شده
در پاسخ به: {{ reply.reply_to.name }}
در پاسخ به
این پیام حذف شده است.