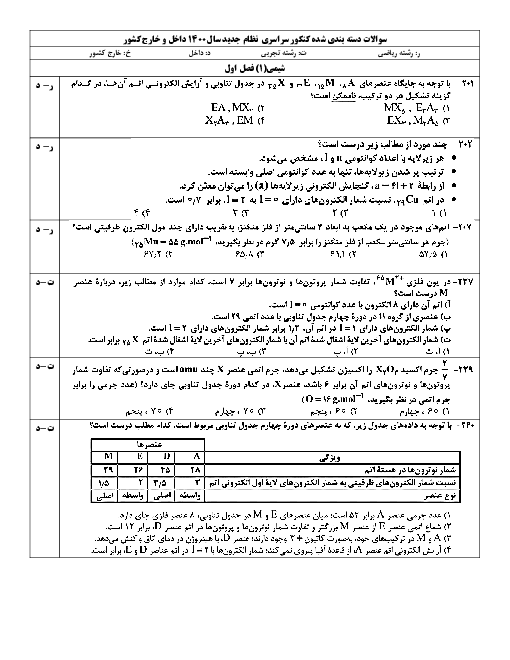
PH محلول 0.1mol.l هیدروفلوئوریک اسید با درصد یونش 4.8 درصد، چقدر است؟ 1) 2.6 2) 2.3 3) 2.8 4) 2
PH محلول 0.1mol.l هیدروفلوئوریک اسید با درصد یونش 4.8 درصد، چقدر است؟
پاسخ ها: {{ repliesNum }}
پاسخ انتخاب شده
در پاسخ به: {{ reply.reply_to.name }}
در پاسخ به
این پیام حذف شده است.