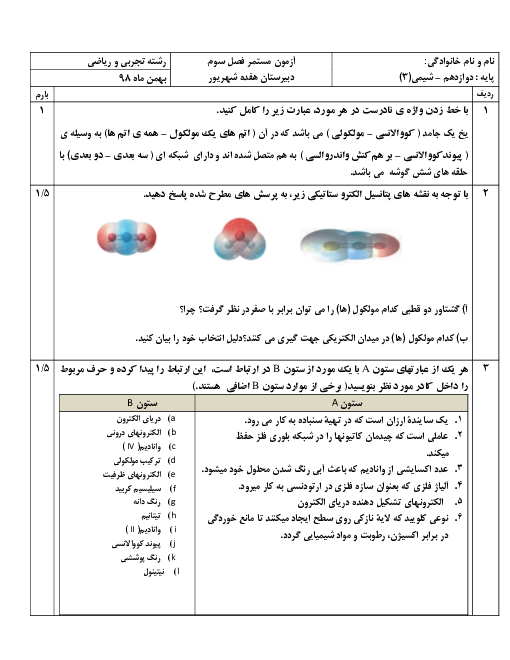
در دمای اتاق از بین دو محلول یک مولار استیک اسید و هیدروکلریک اسید،کدام اسیدی تر است؟ و غلظت یون هیدرونیوم در کدام محلول بیشتر است؟!
قدرت اسیدی استیک اسیدو هیدروکلریک اسید
پاسخ ها: {{ repliesNum }}
پاسخ انتخاب شده
در پاسخ به: {{ reply.reply_to.name }}
در پاسخ به
این پیام حذف شده است.