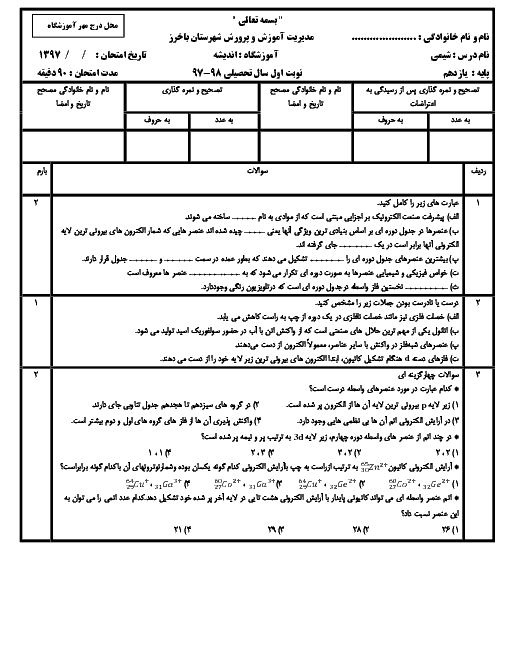
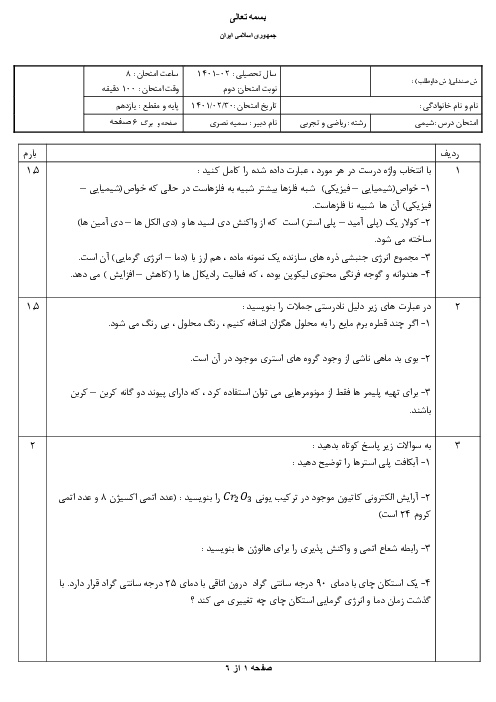
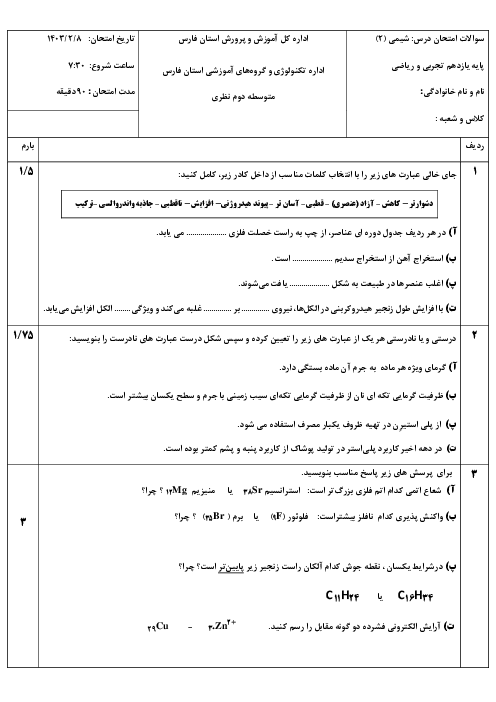
دو عنصر A و B در یک گروه جدول دورهای عنصرها قرار دارند. اگر عنصر A نسبت به عنصر B در واکنش، آسان تر الکترون از دست بدهد، کدام گزینه دربارهٔ این دو عنصر صحیح است؟
1 )
عنصر A و B میتوانند بهترتیب عناصر Na و Rb باشند.
2 )
شدت واکنش عنصر B با گاز کلر نسبت به عنصر A بیشتر است.
3 )
نماد آخرین زیر لایهٔ الکترونی عناصر A و B میتواند بهترتیب بهصورت $2{{p}^{5}}$ و $3{{p}^{5}}$ باشد.
شعاع اتمی عنصر A بزرگتر از شعاع اتمی عنصر B است.
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!