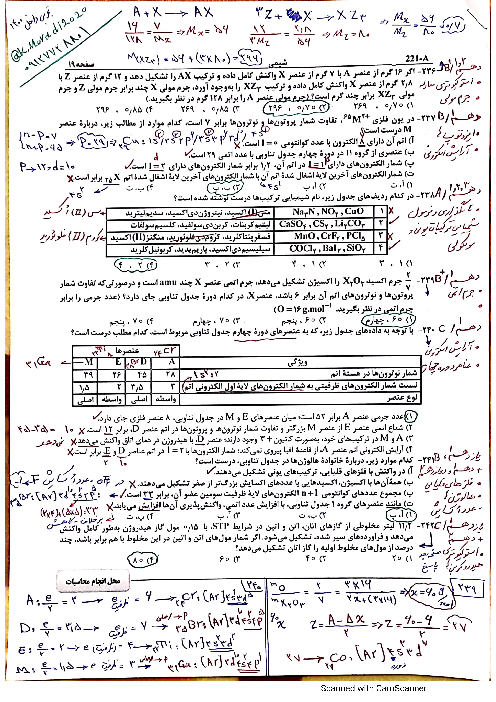
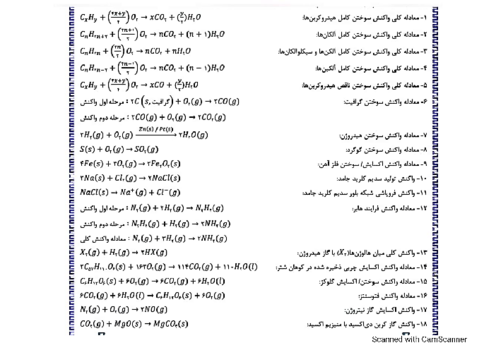
دربارهٔ دو واکنش دادهشده، کدام مورد درست است؟ (معادلهٔ واکنشها موازنه شود، هر دو واکنش، سرعت انجام بالایی دارند و گرما تولید میکنند.)
$I){C_4}{H_9}OH(g) + {O_2}(g) \to C{O_2}(g) + {H_2}O(g)$
$II)C{H_3}N{O_2}(g) + {O_2}(g) \to C{O_2}(g) + {H_2}O(g) + {N_2}(g)$
1 )
فقط واکنش $I$ از نوع سوختن است و مجموع ضرایب استوکیومتری واکنشدهندهها در دو واکنش، باهم برابر است.
هر دو واکنش، از نوع سوختن است و بهازای تشکیل 1/25 مول بخار آب در واکنش $II$، 06/25 مول گاز اکسیژن مصرف میشود.
3 )
هر دو واکنش از نوع سوختن است و بهازای مصرف مولهای برابر از واکنشدهندهٔ کربندار در آنها، مقدار برابر از کربن دیاکسید تشکیل میشود.
4 )
فقط واکنش $I$ از نوع سوختن است و تفاوت ضرایب استوکیومتری واکنشدهندههای کربندار در دو واکنش، نصف ضریب استوکیومتری یکی از فراوردهها در واکنش $II$ است.
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!