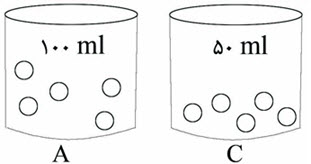
در مقایسه غلظت مولار جسم حل شده در دو ظرف داریم:
ظرف A:
$M=\frac{n}{V}=\frac{5(0/01)}{\frac{1}{10}L}=\frac{\frac{5}{100}}{\frac{1}{10}}=\frac{5}{10}\frac{mol}{L}$
ظرف C:
$M=\frac{n}{V}=\frac{5(0/01)}{\frac{5}{100}L}=\frac{\frac{5}{100}}{\frac{5}{100}}=1\frac{mol}{L}$
پس غلظت مولار در ظرف C، 2 برابر ظرف A می باشد.
*چگالی عبارت است از نسبت جرم ماده حل شده به حجم. چون مقدار ماده حل شده در هر دو ظرف برابر است پس هر کدام دارای حجم بیشتر باشدف چگالی کمتری خواهد داشت: چگالی A کمتر از چگالی C و حجمA بیشتر از حجم C می باشد.
* درصد جرمی عبارت است از مقدار ماده حل شده (g) در 100 گرم محلول. مقدار ماده حل شده در هر دو ظرف برابر است پس هر کدام مقدار محلول بیشتری داشته باشد، درصد جرمی کمتری دارد. (در نظر بگیریم که چگالی آب خالص برابر $\frac{1g}{mL}$ است پس با افزودن جسم حل شده، چگالی محلول آبی، افزایش می یابد و بزرگتر از 1 خواهد شد.)