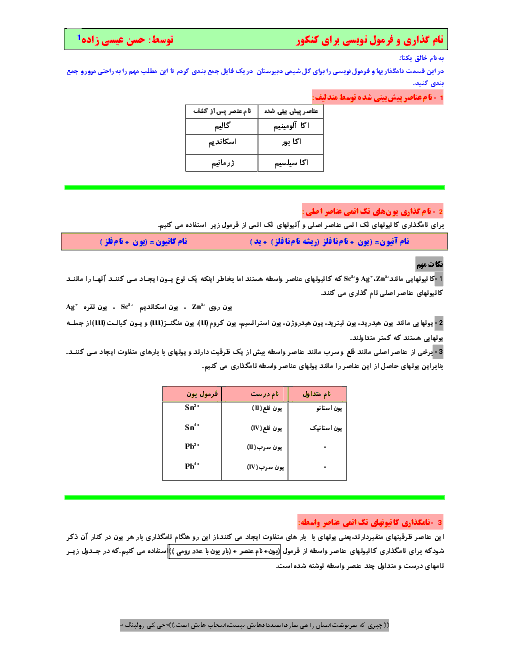
عبارتهای اول و دوم درستاند. ابتدا محاسبهٔ غلظت مولی محلولها:
$\left[ HX \right]=\frac{\frac{18g}{60g.mo{{l}^{-1}}}}{2L}=0/15mol.{{L}^{-1}}$
$\left[ HY \right]=\frac{\frac{10g}{50g.mo{{l}^{-1}}}}{2L}=0/1mol.{{L}^{-1}}$
با توجه به اینکه $pH$ محلولها و در نتیجه $\left[ {{H}^{+}} \right]$ در دو محلول با هم برابر است، خواهیم داشت:
$\underset{0/15-x}{\mathop{HX}}\,\rightleftharpoons \underset{x}{\mathop{{{H}^{+}}}}\,+\underset{x}{\mathop{{{X}^{-}}}}\,,\underset{0/1-x}{\mathop{HY}}\,\rightleftharpoons \underset{x}{\mathop{{{H}^{+}}}}\,+\underset{x}{\mathop{{{Y}^{-}}}}\,$
بریم سراغ عبارتها:
همانطور که میبینید شمار یونهای موجود در دو محلول $(x+x=2x)$ با هم برابر است.
به دلیل متفاوتبودن غلظت تعادلی اسیدها، شمار کل گونهها در دو محلول با هم برابر نیست:
مجموع غلظت گونهها در محلول: $HX=0/15-x+x+x=0/15+x$
مجموع غلظت گونهها در محلول: $HY=0/1-x+x+x=0/1+x$
$HY$ با غلظت مولی کمتر، توانسته به اندازهٔ $HX$، ${{H}^{+}}$ تولید کند؛ پس قطعاً ثابت یونش $HY$ بزرگتر است. از رابطه هم میتونستیم به جواب برسیم:
$\left\{ \begin{matrix} {{K}_{a}}(HX)=\frac{{{x}^{2}}}{0/15-x} \\ {{K}_{a}}(HY)=\frac{{{x}^{2}}}{0/1-x} \\ \end{matrix} \right.\Leftarrow {{K}_{a}}(HY)\gt {{K}_{a}}(HX)$
درجهٔ یونش $HY$، 1/5 برابر $HX$ است:
$\left\{ \begin{matrix} \alpha (HX)=\frac{\left[ {{H}^{+}} \right]}{\left[ HX \right]}=\frac{x}{0/15} \\ \alpha (HY)=\frac{\left[ {{H}^{+}} \right]}{\left[ HY \right]}=\frac{x}{0/1} \\ \end{matrix} \right.\Rightarrow \frac{\alpha (HY)}{\alpha (HX)}=\frac{\frac{x}{0/1}}{\frac{x}{0/15}}=\frac{0/15}{0/1}=1/5$
با توجه به محاسبات قبل، درجهٔ یونش $HX$، حدود 0/67 درجهٔ یونش $HY$ است.
$\frac{\alpha (HX)}{\alpha (HY)}=\frac{1}{1/5}=\frac{2}{3}\simeq 0/67$