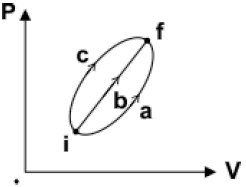
برای مقدار معینی گاز کامل، انرژی درونی فقط تابع دمای مطلق گاز است. بنابراین در این سؤال چون ابتدا و انتها برای هر سه مسیر یکسان است. بنابراین تغییرات انرژی درونی در هر سه مسیر یکسان خواهد بود و از طرفی چون فشار و حجم در انتهای مسیر بیشتر از فشار و حجم در ابتدای مسیر است. بنابراین دمای مطلق در انتهای مسیر بیشتر از ابتدای مسیر است و بنابراین داریم:
$\Delta {{U}_{a}}=\Delta {{U}_{b}}=\Delta {{U}_{c}} \gt 0\,\,\,\,\,(1)$
از طرفی مساحت زیر نمودار $P-V$ و محور حجم برابر با اندازهی کاری است که محیط روی گاز انجام میدهد و چون فرایند انبساطی است، کار محیط روی گاز منفی است.
${{S}_{a}} \lt {{S}_{b}} \lt {{S}_{c}}\Rightarrow \left| {{W}_{a}} \right| \lt \left| {{W}_{b}} \right| \lt \left| {{W}_{c}} \right|\xrightarrow[W \lt 0]{Farayande\,\,Enbesati}{{W}_{c}} \lt {{W}_{b}} \lt {{W}_{a}} \lt 0\,\,\,\,\,(2)$
با توجه به قانون اول ترمودینامیک $(\Delta U=Q+W)$ و روابط $(1)$ و $(2)$، میتوان نتیجه گرفت:
${{Q}_{c}} \gt {{Q}_{b}} \gt {{Q}_{a}} \gt 0$