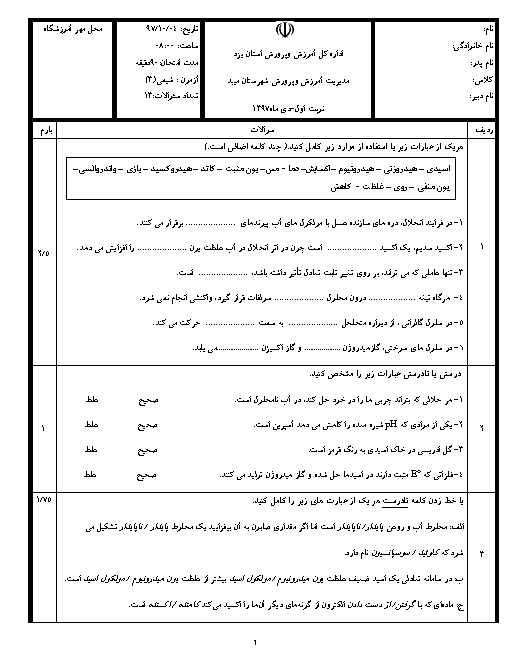
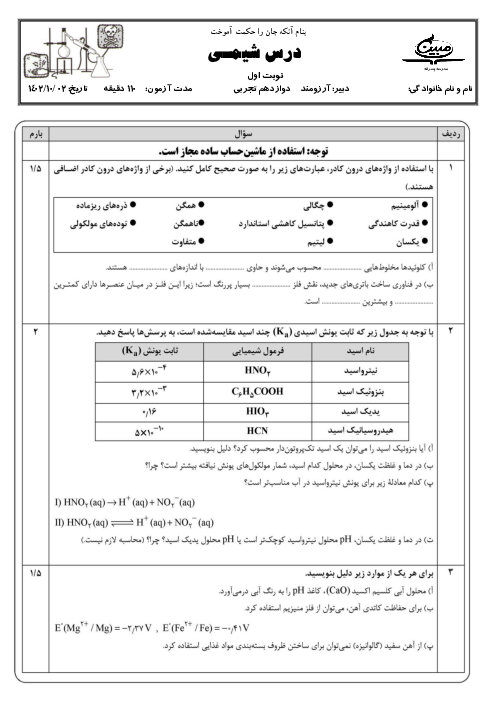
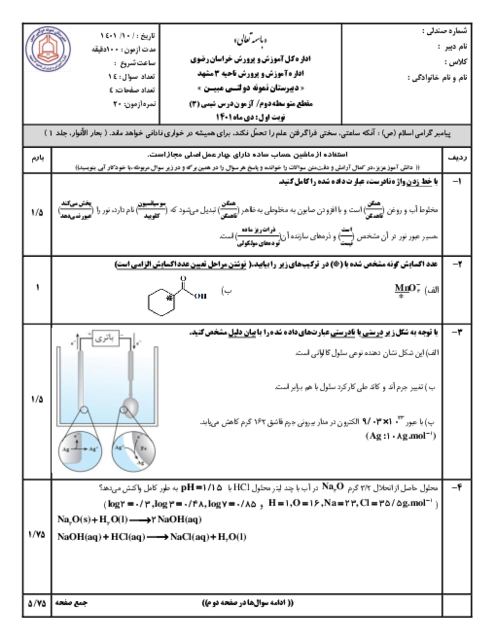
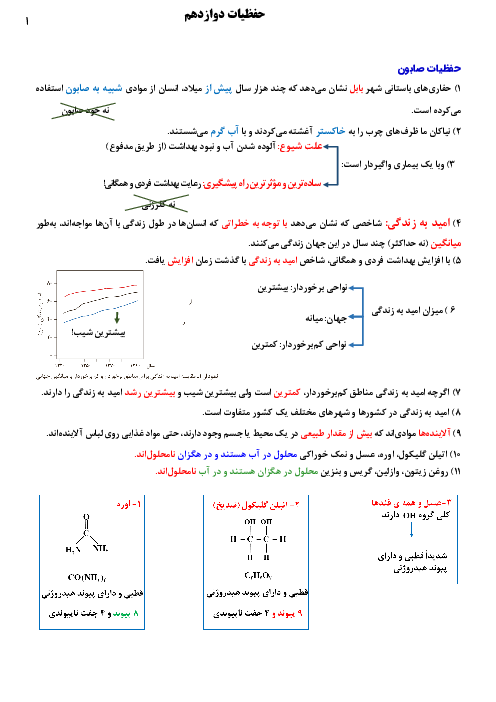
فلز آلومینیم نقشی کلیدی در صنایع گوناگون دارد و با استفاده از روش هال استخراج میگردد. با توجه به این روش در صورتیکه 21/6 تن آلومینیوم تولید شده باشد، چند مول الکترون طی این واکنش انتقال یافته و چند متر مکعب گاز $C{{O}_{2}}$ تولید خواهد شد؟ (چگالی گاز $C{{O}_{2}}$ برابر 1/1 گرم بر لیتر است.) $Al=27,C=12,O=16:g.mo{{l}^{-1}})$
$24\times {{10}^{3}},2/4\times {{10}^{6}}$
2 )
$24\times {{10}^{2}},2/4\times {{10}^{6}}$
3 )
$12\times {{10}^{3}},4/8\times {{10}^{5}}$
4 )
$12\times {{10}^{3}},4/8\times {{10}^{6}}$
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!