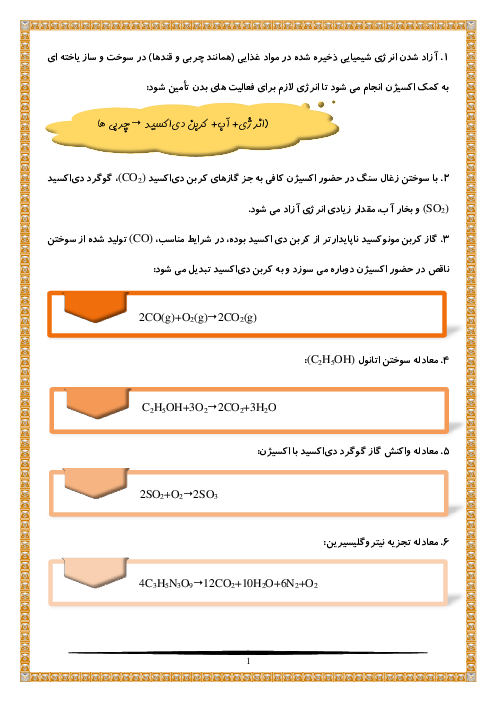
اگر $200$ میلیلیتر محلول هیدروبرمیک اسید با $pH=4/3$ را با $300$ میلیلیتر استرانسیم هیدروکسید با $pH=9/36$ مخلوط کنیم، غلظت مولی نمک تولید شده کدام است؟ (محلول اسیدی به طور کامل مصرف شده و مقداری از محلول بازی باقی میماند.)
1 )
$4\times {{10}^{-5}}$
2 )
$2\times {{10}^{-5}}$
3 )
$2/5\times {{10}^{-5}}$
${{10}^{-5}}$
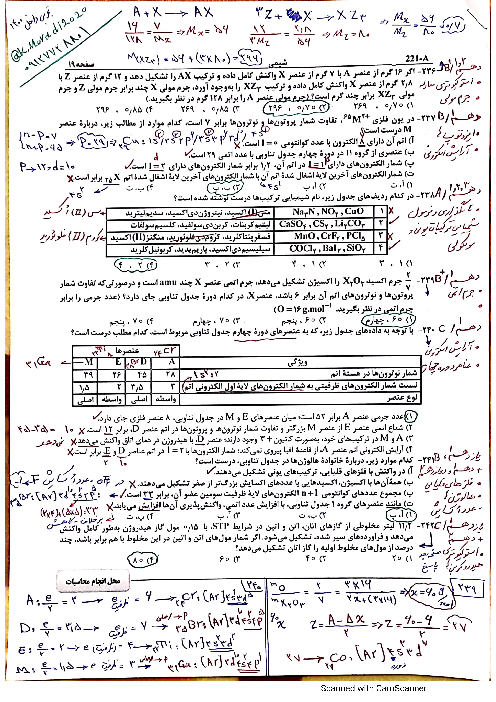
پاسخ تشریحی :
تحلیل ویدئویی تست
تحلیل ویدئویی برای این تست ثبت نشده است!