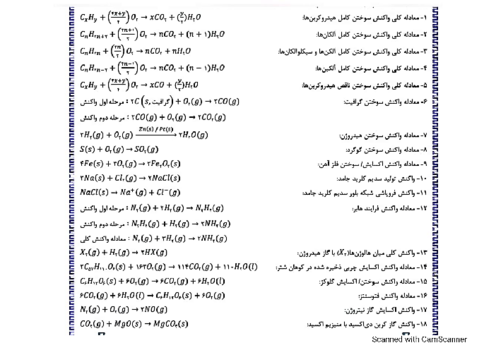
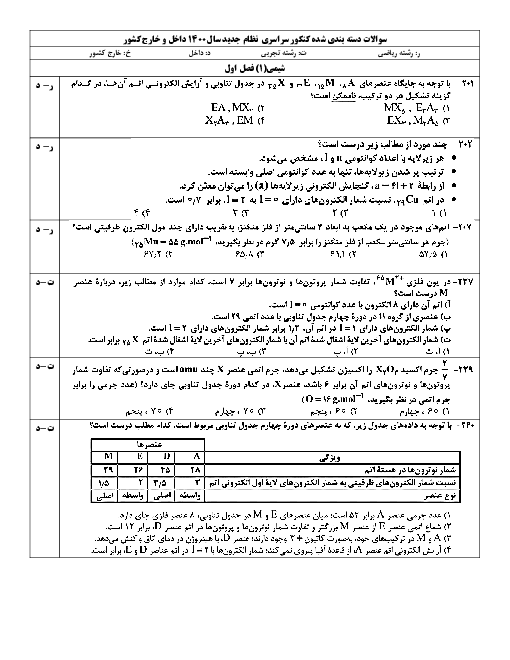
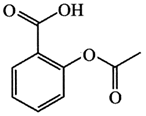
6/75 گرم از ترکیب آلی زیر را در مقدار کافی آب خالص حل کرده، به حجم 750 میلیلیتر میرسانیم. غلظت محلول حاصل چند مول بر لیتر است و در دما و فشار اتاق، $pH$ این محلول، در مقایسه با $pH$ محلول آبی نیتریک اسید که در هر میلیلیتر آن، 3/15 میلیگرم حلشونده وجود دارد، چگونه است؟ $(O=16,C=12,N=14,H=1:gmo{{l}^{-1}})$
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!