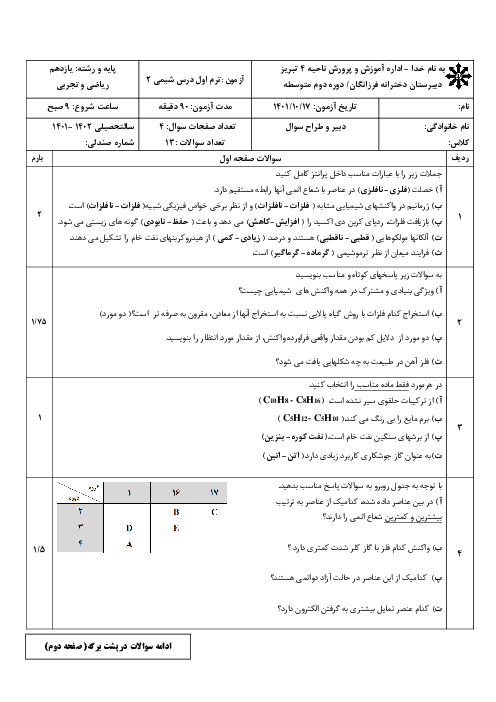
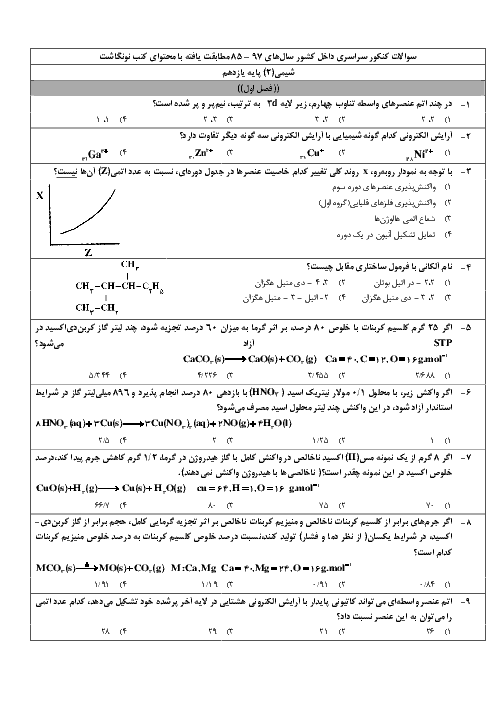
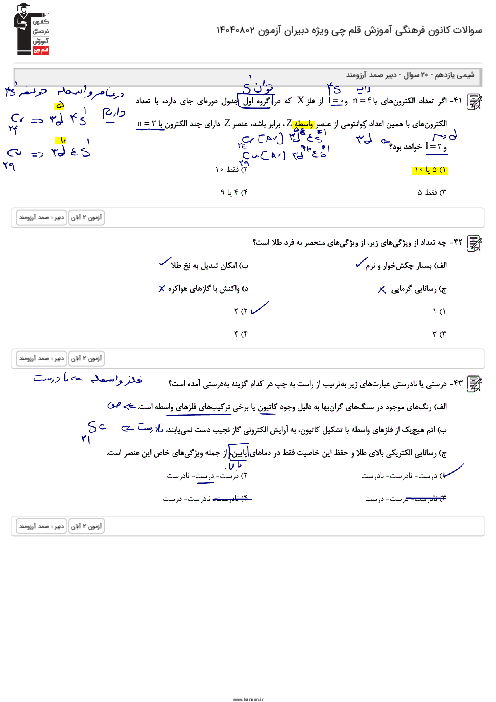
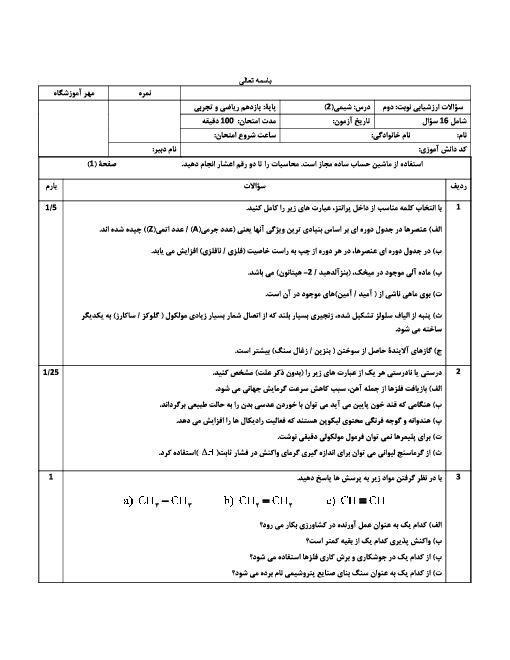
با توجه به واکنشهای داده شده پاسخ دهید:
$\eqalign{
& 1){N_2}(g) + 3{H_2}(g) \to 2N{H_3}(g)/Q = - 92kJ \cr
& 2){N_2}{H_4}(g) + {H_2}(g) \to 2N{H_3}(g)/Q = - 183kJ \cr} $
الف) چرا گرمای آزاد شده در دو واکنش متفاوت است؟ توضیح دهید.
ب) در کدام واکنش، مواد واکنش دهنده پایدارتر است؟ چرا؟
ج) نمودار انرژی این دو واکنش را رسم کنید.
پاسخ تشریحی :

تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!