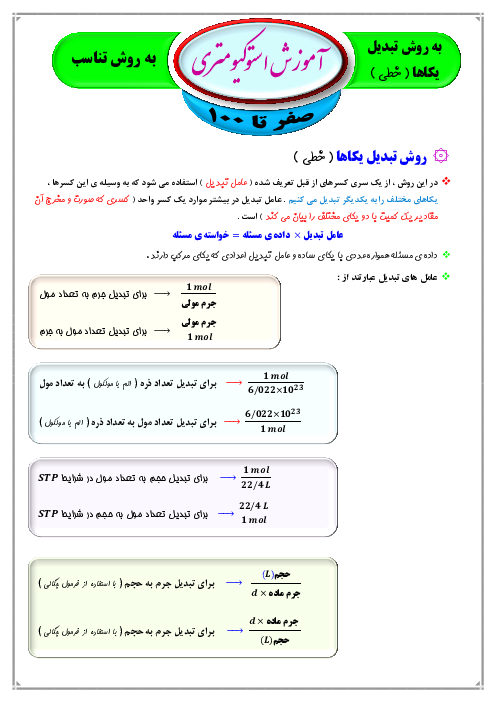
با توجه به واکنشهای دادهشده، اگر x گرم کربن و y گرم گاز هیدروژن در دو ظرف جداگانه، با مقدار برابر از گاز اکسیژن، واکنش کامل دهند و در مجموع 193/2 کیلوژول گرما آزاد شود، x+y کدام است و در هر واکنش، چند مول اکسیژن مصرف شده است؟ $(H = 1\,,\,C = 12:g.mo{l^{ - 1}})$
$I)\,C(s) + {O_2}(g) \to C{O_2}(g)\,\,\,\,\,\,,\,\,\,\,\,\,\Delta H = - 394kJ$
$II)\,{H_2}(g) + \frac{1}{2}{O_2}(g) \to {H_2}O(l)\,\,\,\,\,\,,\,\,\,\,\,\,\Delta H = - 286kJ$
2 )
2/8 ، 0/23 )
3/2 ، 0/14 )
2/8 ، 0/1تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!