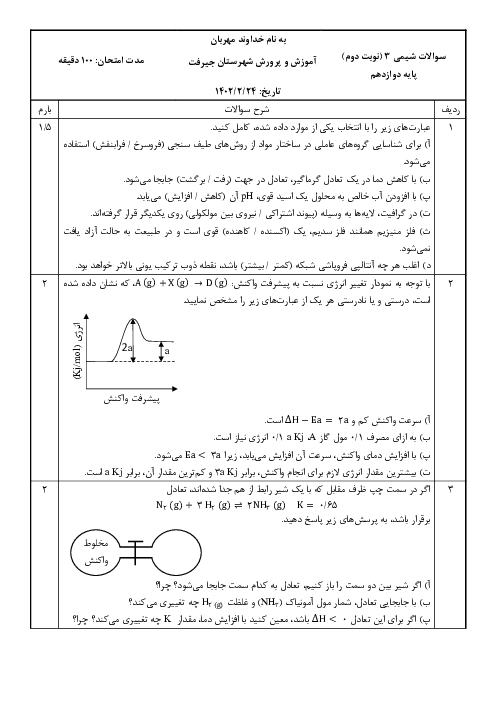
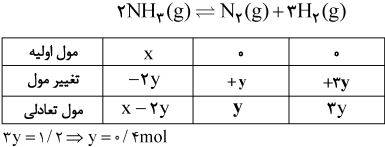اگر در واکنش تعادلی تجزیۀ آمونیاک: $2N{{H}_{3}}(g)\rightleftharpoons {{N}_{2}}(g)+3{{H}_{2}}(g),K=12mo{{l}^{2}}.{{L}^{-2}}$ ، که در یک ظرف دو لیتری در بسته در دمای معین برقرار است، مقدار 1/2 مول گاز هیدروژن وجود داشته باشد، مقدار اولیۀ آمونیاک برابر چند مول بوده است؟