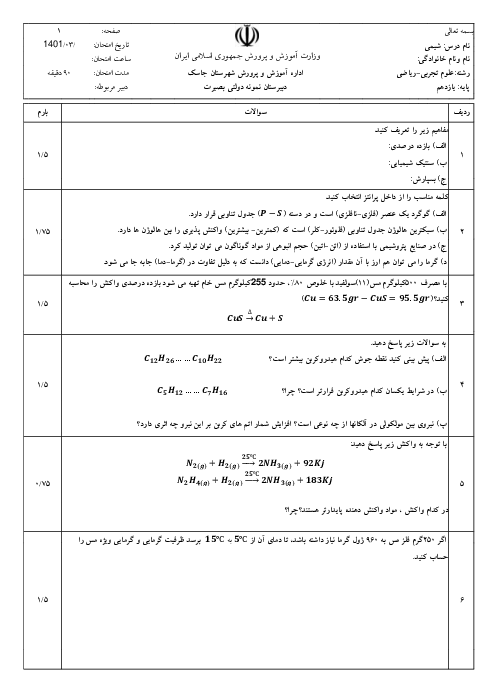
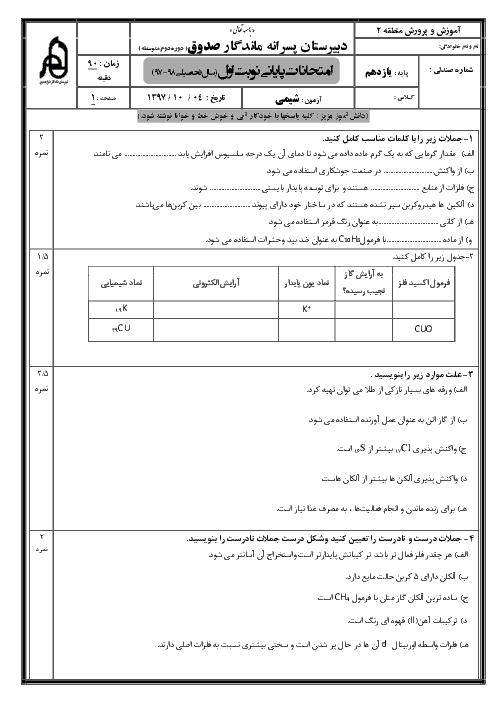
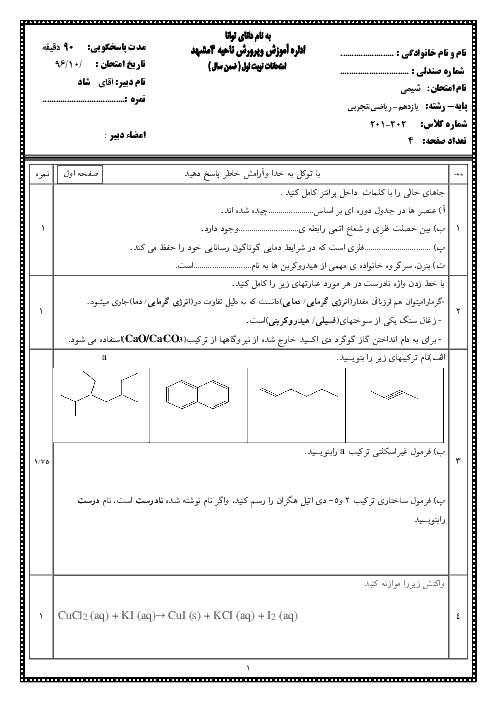
با توجه به واکنشهای زیر، اگر 8/1 گرم آلومینیم با مقدار کافی هیدروکلریک اسید واکنش دهد، چند کیلوژول گرما آزاد میشود؟ $(Al=27g.mo{{l}^{-1}})$
$I)2Al(s)+3C{{l}_{2}}(g)\to 2AlC{{l}_{3}}(s),\Delta H=-1406kJ$
$II)HCl(g)\to HCl(aq),\Delta H=-75kJ$
$III){{H}_{2}}(g)+C{{l}_{2}}(g)\to 2HCl(g),\Delta H=-184kJ$
$IV)AlC{{l}_{3}}(s)\to AlC{{l}_{3}}(aq),\Delta H=-323kJ$