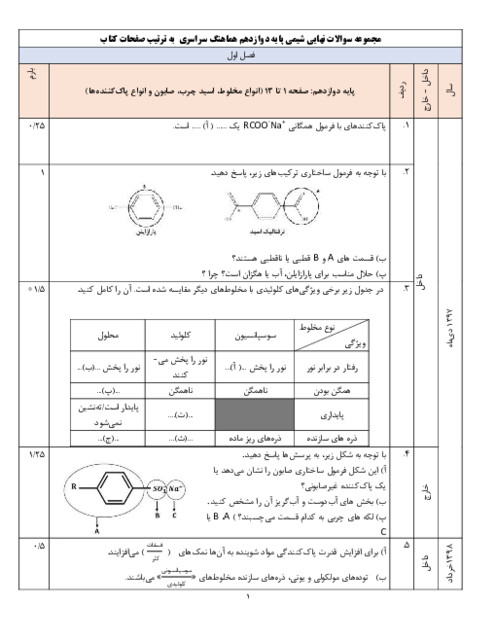
واضح است که غلظت مولی دو محلول با هم برابر است.
$\frac{{{K}_{a}}(HA)}{{{K}_{a}}(HX)}=\frac{{{({{\left[ {{H}^{+}} \right]}^{2}}/M)}_{HA}}}{{{({{\left[ {{H}^{+}} \right]}^{2}}/M)}_{HX}}}=\frac{{{\left[ {{H}^{+}} \right]}^{2}}_{HA}}{{{\left[ {{H}^{+}} \right]}^{2}}_{HX}}$
$\Rightarrow \frac{1/75\times {{10}^{-4}}}{7\times {{10}^{-6}}}=\frac{{{\left[ {{H}^{+}} \right]}^{2}}_{HA}}{{{\left[ {{H}^{+}} \right]}^{2}}_{HX}}\Rightarrow 5=\frac{{{\left[ {{H}^{+}} \right]}_{HA}}}{{{\left[ {{H}^{+}} \right]}_{HX}}}$
$\xrightarrow{\log }0/7\simeq p{{H}_{(HA)}}-p{{H}_{(HX)}}$