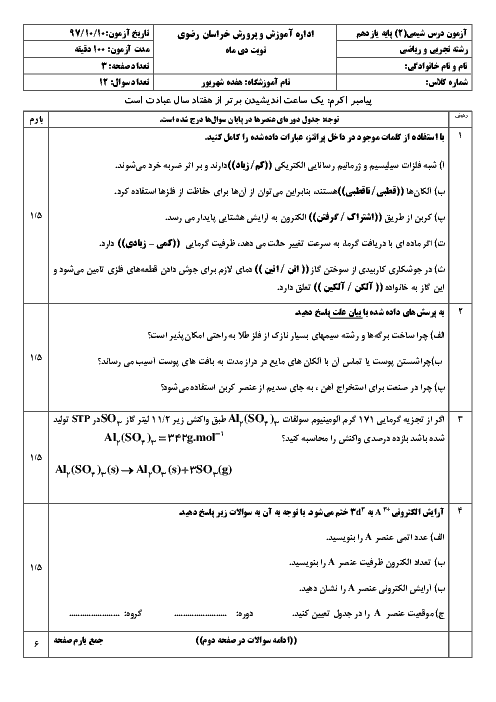
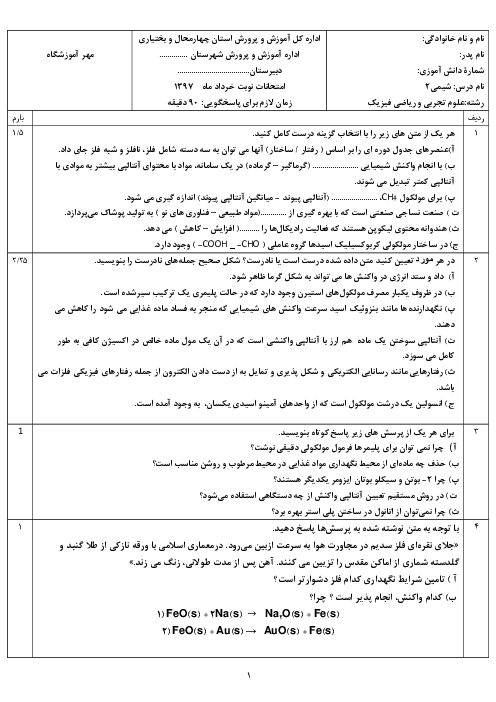
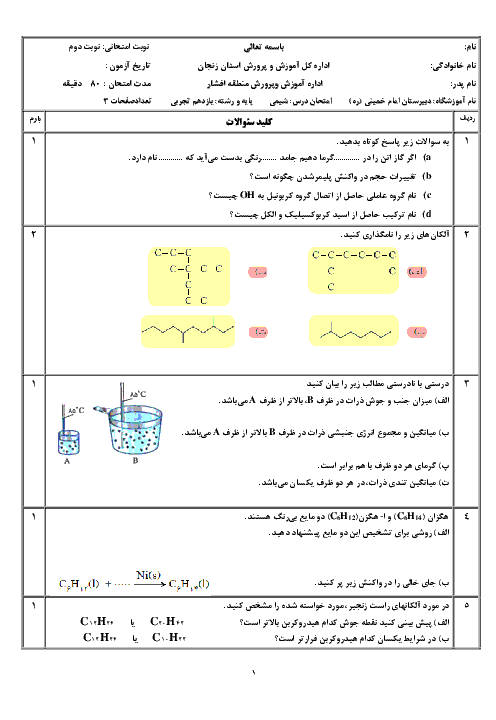
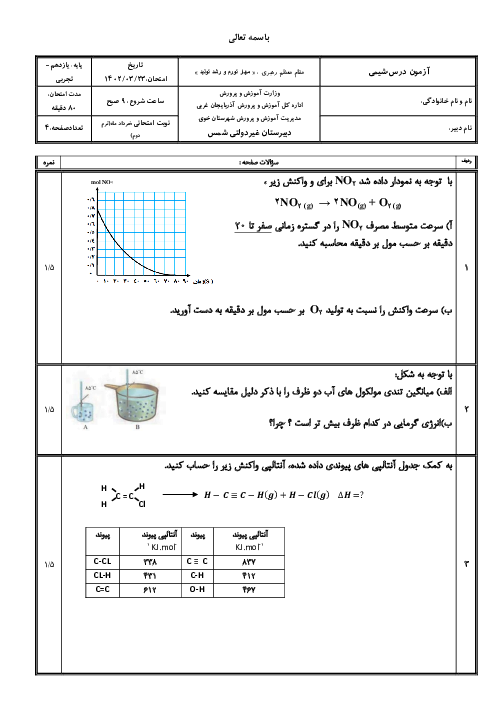
هرگاه با انجام واكنش موازنه نشدهٔ زير در زمان 80 ثانيه، 0/28 ليتر گاز نيتروژن در شرايط استاندارد آزاد شده باشد، سرعت متوسط مصرف آمونيوم دیکرومات $({{(N{{H}_{4}})}_{2}}C{{r}_{2}}{{O}_{7}})$، به تقریب چند مول بر دقیقه خواهد بود؟
${{(N{{H}_{4}})}_{2}}C{{r}_{2}}{{O}_{7}}(s)\to C{{r}_{2}}{{O}_{3}}(s)+{{N}_{2}}(g)+{{H}_{2}}O(l)$
1 )
$9/4\times {{10}^{-2}}$
2 )
$2/1\times {{10}^{-4}}$
$9/4\times {{10}^{-3}}$
4 )
$2/1\times {{10}^{-3}}$
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!