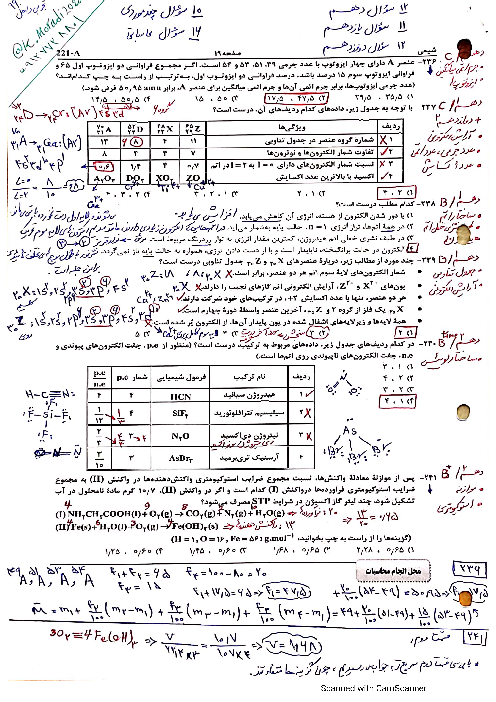
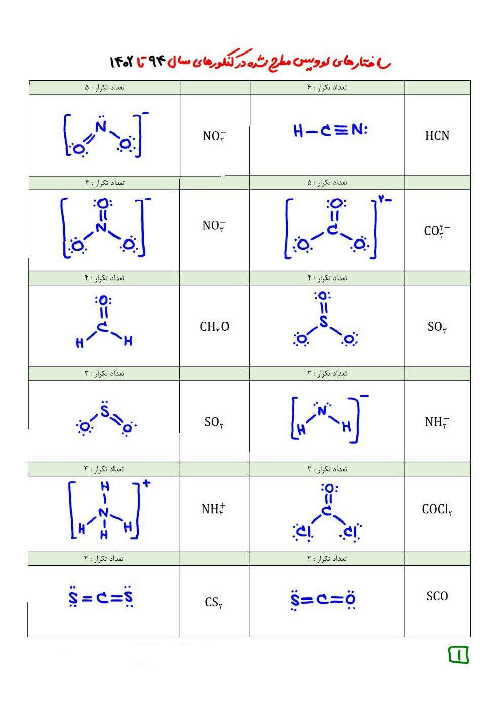
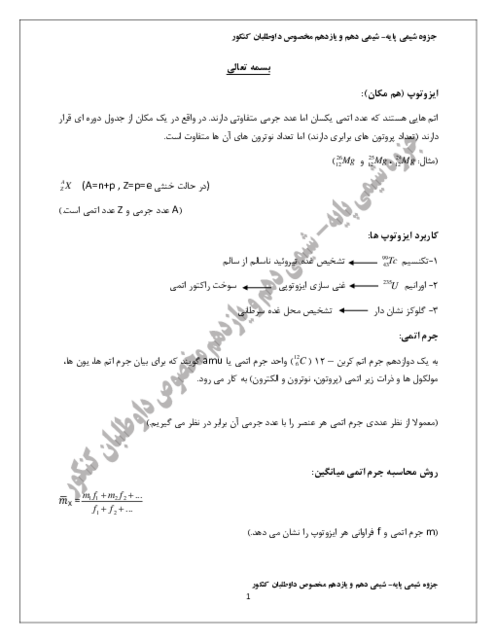$pH$ محلول 0/1 مولار هیدروفلوئوریک اسید برابر 2/7 است. درصد یونش تقریبی آن کدام است و 200 میلی لیتر از این محلول در واکنش با مقدار کافی کلسیم هیدروکسید، چند میلیگرم رسوب کلسیم فلوئورید تشکیل میدهد؟ $(Ca = 40,F = 19:g.mo{l^{ - 1}})$
$Ca{(OH)_2}(aq) + HF(aq) \to Ca{F_2}(s) + {H_2}O(l)$ معادلهٔ واکنش موازنه شود
تحلیل ویدئویی تست
تحلیل ویدئویی برای این تست ثبت نشده است!