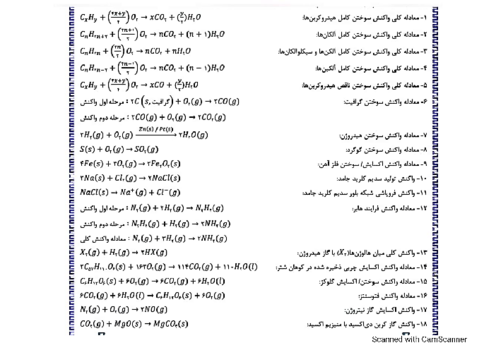
از انحلال 5/57 گرم فرمیک اسید در آب در یک دمای مشخص، محلولی با $pH = 2/3$ بهدست میآید. اگر ثابت یونش اسید برابر $2 \times {10^{ - 5}}$ باشد، حجم محلول، بهتقریب، برابر چند لیتر است و بهتقریب، چند گرم دیگر فرمیک اسید باید به محلول، در همان دما اضافه شود تا $pH = 2/1$ شود؟ (از تغییر حجم محلول بر اثر اضافه کردن فرمیک اسید صرفنظر شود، $O = 16:g.mo{l^{ - 1}}$ ، $C = 12$ ، $H = 1$)
تحلیل ویدئویی تست
تحلیل ویدئویی برای این تست ثبت نشده است!