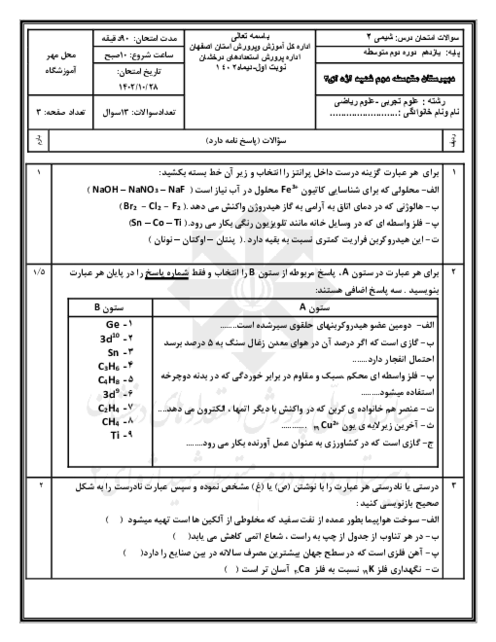
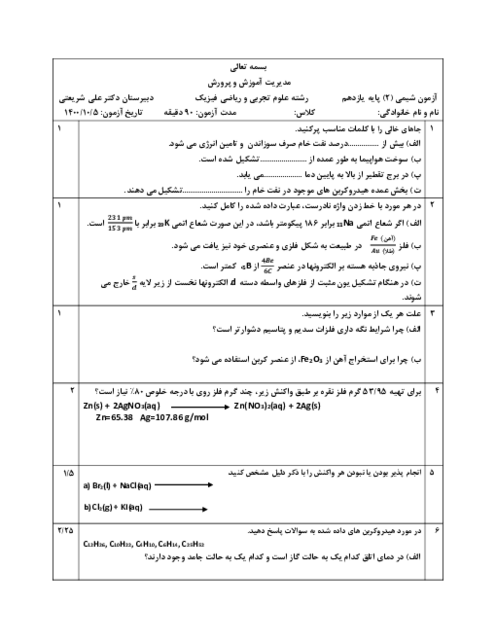
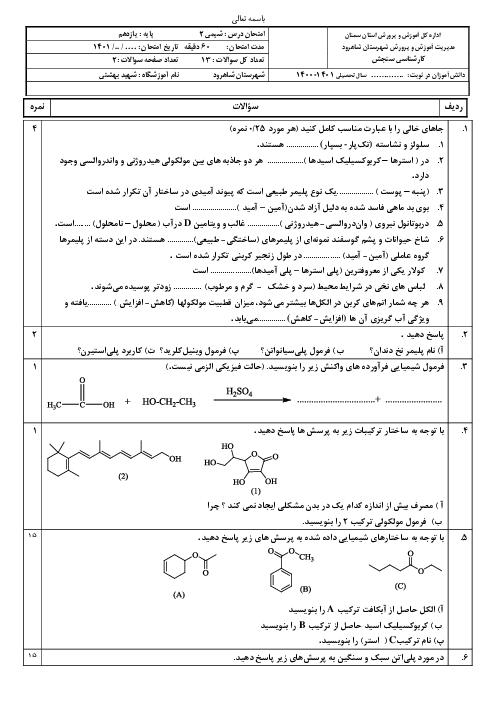
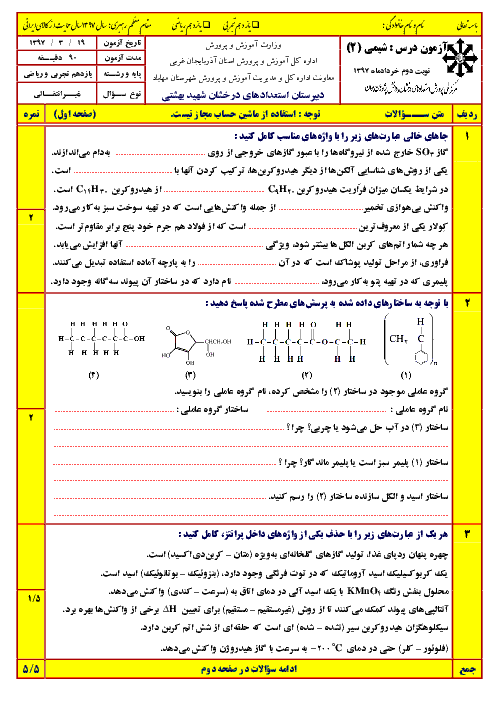
در یک یخچال صحرایی، یک لیوان حاوی مقدار مشخصی از اتانول با دمای ${{40}^{{}^\circ }}C$ قرار دارد. چند گرم آب باید از بدنهٔ ظرف تبخیر شود تا دمای اتانول به ${{30}^{{}^\circ }}C$ کاهش یابد؟ (ظرفیت گرمایی اتانول موجود در ظرف برابر $5/5\frac{j}{^{\circ }C}$ و برای تبخیر یک مول آب 44 کیلوژول انرژی نیاز است.)
$(H=1,\,\,O=16:g.mo{{l}^{-1}})$
1 )
$2/5\times {{10}^{-2}}$
$2/25\times {{10}^{-2}}$
3 )
$2/25\times {{10}^{-3}}$
4 )
$2/5\times {{10}^{-3}}$