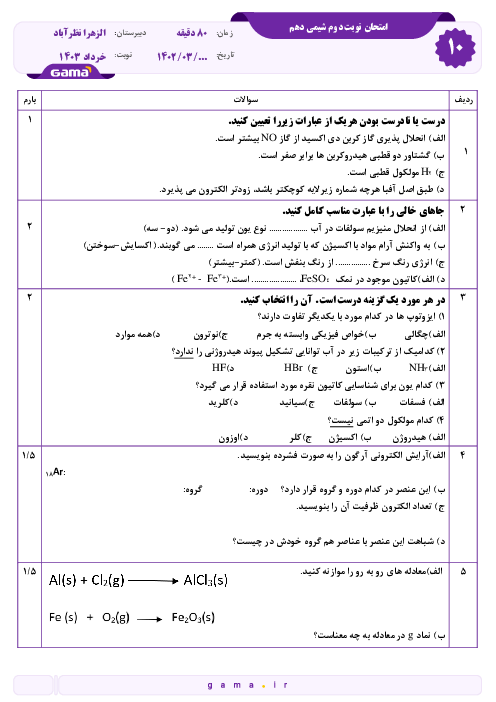
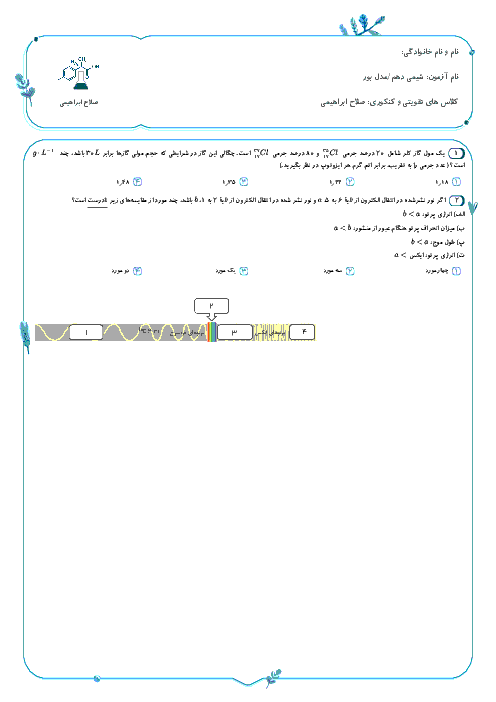
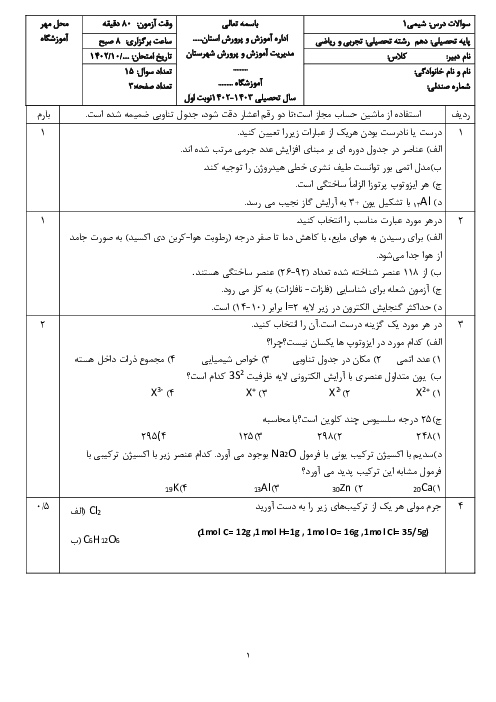
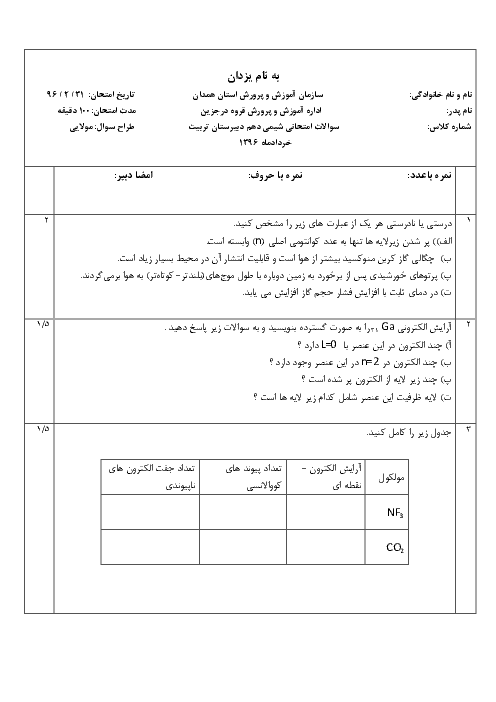
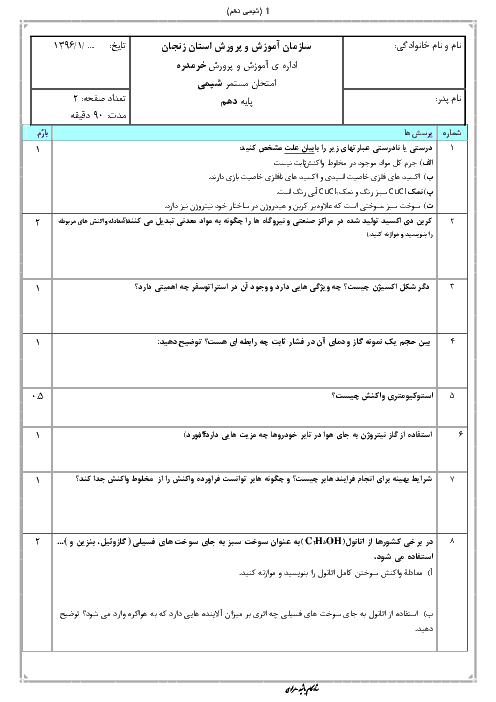
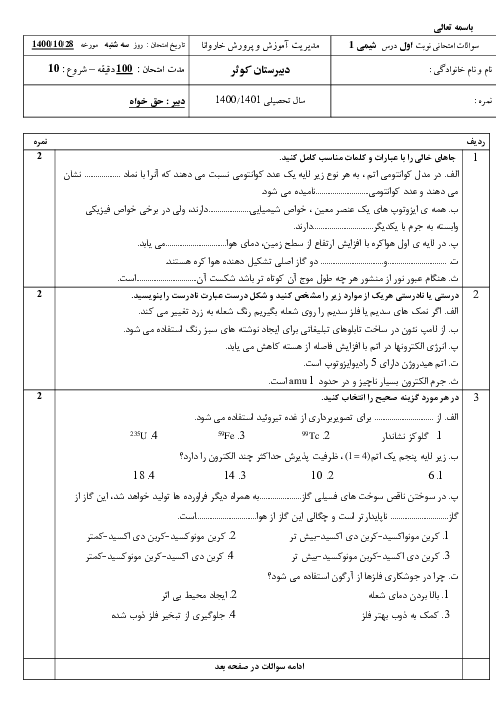
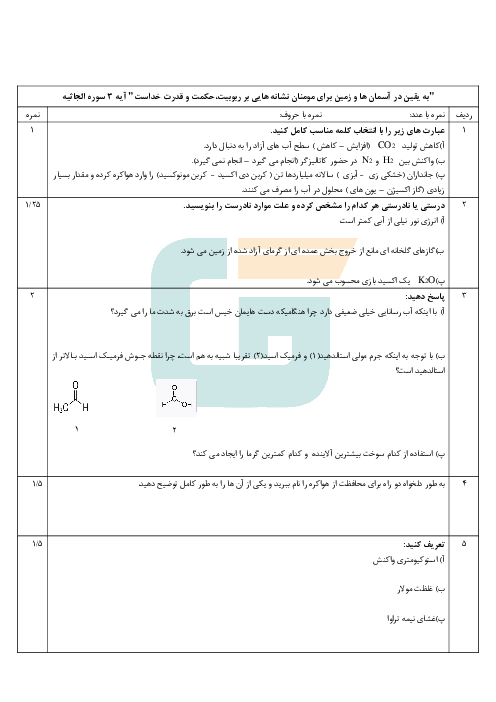با توجه به اين كه تمام يونهای پتاسيم موجود در اين نمونه، حاصل حل شدن پتاسيم سولفات است، مقدار پتاسيم سولفات حل شده در اين نمونه را به كمك ميزان يون پتاسيم محاسبه میكنيم.
$?g{{K}_{2}}S{{O}_{4}}=1L\times \frac{1000mL}{1L}\times \frac{1/2g}{1mL}\times \frac{0/2mol{{K}^{+}}}{10000g}\times \frac{1mol{{K}_{2}}S{{o}_{4}}}{2mol{{K}^{+}}}\times \frac{174g{{K}_{2}}S{{O}_{4}}}{1mol{{K}_{2}}S{{O}_{4}}}=2/088\simeq 2g{{K}_{2}}S{{O}_{4}}$
نكته: فرمول شيميايی پتاسيم سولفات، ${{K}_{2}}S{{O}_{4}}$ است پس 2 مول يون پتاسيم میتواند يك مول پتاسيم سولفات را تشكيل دهد. اما با توجه به دادههای مساله، 0/2 مول (200 میلیمول) كاتيون پتاسيم داريم كه میتواند با 0/1 مول آنيون سولفات توليد 0/1 مول پتاسيم سولفات نمايد بنابراين يون سولفات موجود در اين نمونه بيش از ميزان يون سولفات حاصل از حل شدن پتاسيم سولفات است.