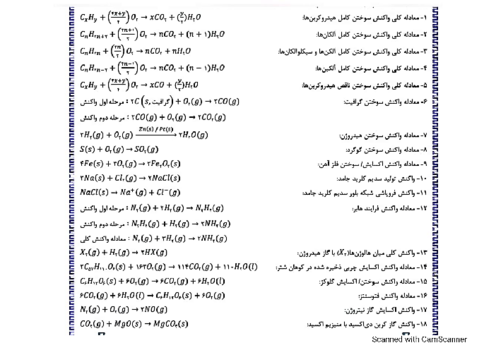
با توجه به واکنشهای زیر، پس از موازنهٔ معادلهٔ آنها، چند مطلب زیر درست است؟
$I)Fe{(OH)_2}(s) + {H_2}O(l) + {O_2}(g) \to Fe{(OH)_3}(s)$ (معادلهٔ واکنشها موازنه شود)
$II)Al{(OH)_3}(s) + {H_2}S{O_4}(aq) \to A{l_2}{(S{O_4})_3}(aq) + {H_2}O(l)$
* برای تشکیل 1070 گرم رسوب $Fe{(OH)_3}$، $12/04 \times {10^{23}}$ مولکول آب نیاز است.
* واکنش $I$، از نوع اکسایش ـ کاهش و واکنش $II$، از نوع خنثیشدن اسید و باز است.
* از واکنش هر مول سولفوریک اسید با آلومینیم هیدروکسید کافی، 36 گرم آب تشکیل میشود.
* مجموع ضریبهای استوکیومتری واکنشدهندهها در واکنش $I$ با مجموع ضریبهای استوکیومتری فراوردهها در واکنش $II$ برابر است. $(Fe = 56,O = 16,H = 1:g.mo{l^{ - 1}})$
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!