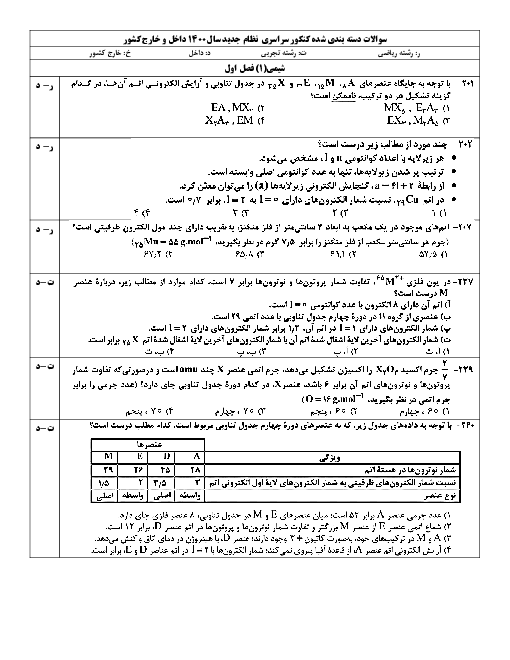
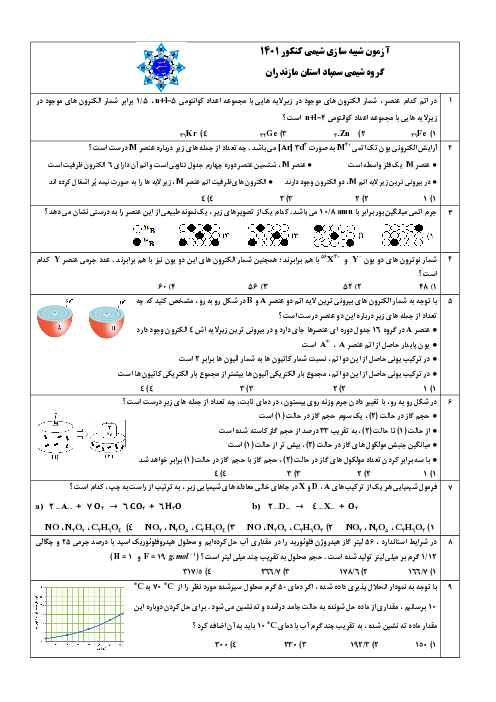
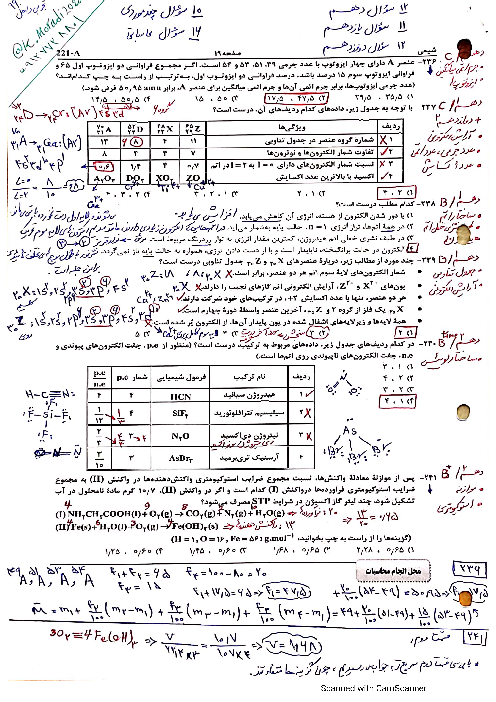
اگر در واکنش به حالت تعادل: $2NO(g) + B{r_2}(g) \rightleftharpoons 2NOBr(g)$، در دمای معین، 66 گرم $NOBr$، 18 گرم $NO$ و 24 گرم $B{r_2}$ در یک ظرف سه لیتری وجود داشته باشد، ثابت تعادل در شرایط آزمایش کدام است و اگر برای رسیدن به این تعادل، 60 درصد از مقدار آغازی $B{r_2}$ مصرف شده باشد، واکنش با چند مول $B{r_2}$ آغاز شده است؟ ($Br = 80:g.mo{l^{ - 1}}$ ، $O = 16$ ، $N = 14$)
تحلیل ویدئویی تست
تحلیل ویدئویی برای این تست ثبت نشده است!