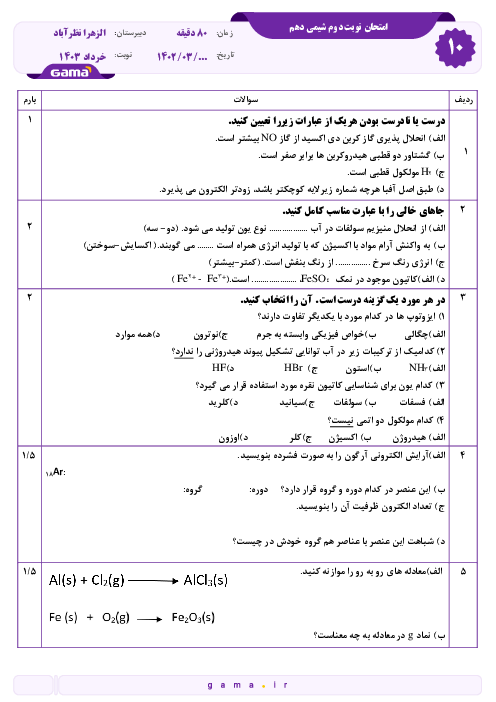
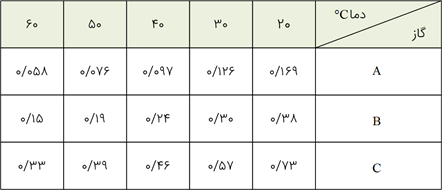
بر اساس دادههای جدول زیر که انحلال پذیری سه گاز را بر حسب گرم در 100 گرم آب در فشار $1 atm$ نشان میدهد، کدام مطلب درست است؟
1 )
انحلال پذیری هر سه گاز با افزایش دما به یک نسبت کاهش مییابد.
2 )
تأثیر افزایش دما بر انحلال گاز C در مقایسه با دو گاز دیگر کمتر است.
3 )
در دمای $35{}^\circ C$ محلول 0/35 گرم گاز C در 100 گرم آب، سیر شده است.
در دمای $35{}^\circ C$ محلول 0/6 گرم گاز B در 200 گرم آب فراسیر شده است.
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!