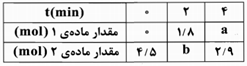
معادلهی موازنهشدهی واکنش دادهشده به صورت زیر است:
$2KCI{{O}_{3}}(s)\to 2KCI(s)+3{{O}_{2}}(g)$
شمار مولهای مادهی (2) با گذشت زمان رو به کاهش است، بنابراین مادهی (2)، واکنشدهنده $(KCI{{O}_{3}})$ است. در مورد مادهی (1) باید گفت: تغییرات شمار مولهای این ماده در 2 دقیقه اول واکنش بیشتر از تغییرات مول مادهی (2) یعنی $KCI{{O}_{3}}$ در 4 دقیقهی اول است. بنابراین ضریب مولی مادهی (1) بیشتر از مادهی (2) یعنی $KCI{{O}_{3}}$ میباشد و در نتیجه مادهی (1) همان ${{O}_{2}}$ است. با پیدا کردن $a$ یا $b$ میتوانیم سرعت متوسط واکنش را به دست آوریم. ما $a$ را تعیین میکنیم:
$\frac{\left| \Delta n(KCI{{O}_{3}}) \right|}{2}=\frac{\Delta n({{O}_{2}})}{3}\Rightarrow \frac{\left| (2/9-4/5) \right|}{2}=\frac{(a-0)}{3}\Rightarrow a=2/4mol$
$\left[ t:2-4\min \right]\Rightarrow {{\overline{R}}_{{{O}_{2}}}}=\frac{(2/4-1/8)mol}{(2\times 60)s}=5\times {{10}^{-3}}mol.{{s}^{-1}}$
$\overline{R}$ واکنش $\frac{{{\overline{R}}_{{{O}_{2}}}}}{3}=\frac{5\times {{10}^{-3}}}{3}=1/67\times {{10}^{-3}}mol.{{s}^{-1}}$