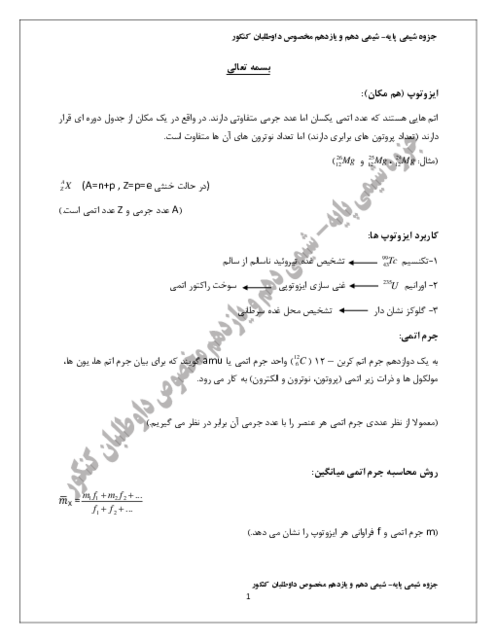فلز روی با هیدروکلریک اسید واکنش داده و گاز ${H_2}$ آزاد میشود.
1) $Zn + 2HCl \to ZnC{l_2} + {H_2}$
واکنش هیدروژندار کردن اتین چنین است:
2) ${C_2}{H_2} + 2{H_2} \to {C_2}{H_6}$
معادله 1 را در 2 ضرب میکنیم تا شمار مولهای هیدروژن با همدیگر برابر شود.
$2Zn + 2HCl \to 2ZnC{l_2} + 2{H_2}$
اکنون میتوان $Zn$ را با اتین مقایسه کرد.
$?gZn = 0/1mol{C_2}{H_2} \times \frac{{2molZn}}{{1mol{C_2}{H_2}}} \times \frac{{65g}}{{1molZn}} = 13gZn$
پس نتیجه میشود که در آلیاژ، 27 گرم مس و 13 گرم روی وجود دارد.
جرم مس تقسیم بر جرم آلیاژ = درصد جرمی مس $ \times 100 \Rightarrow \frac{{27g}}{{40g}} \times 100 = 67/5\% $
همچنین حجم گاز ${H_2}$ حاصل از واکنش $Zn$ با $HCl$ در شرایط استاندارد چنین است:
$?L{H_2} = 13gZn \times \frac{{1mol}}{{65g}} \times \frac{{1mol{H_2}}}{{1molZn}} \times \frac{{22/4L}}{{1mol{H_2}}} = 4/48L$