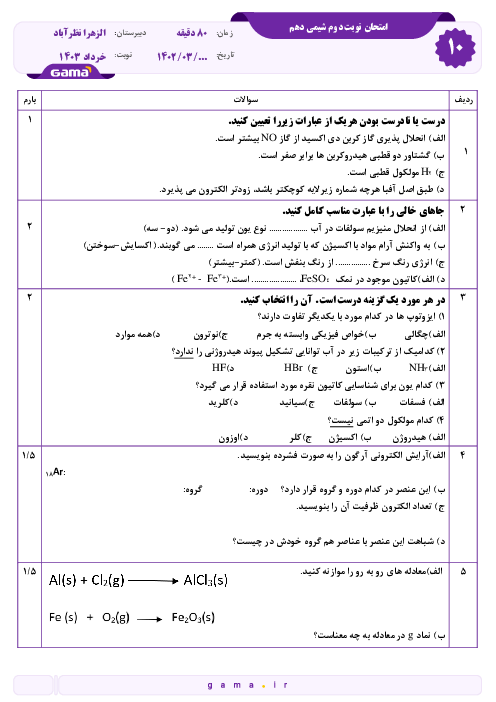
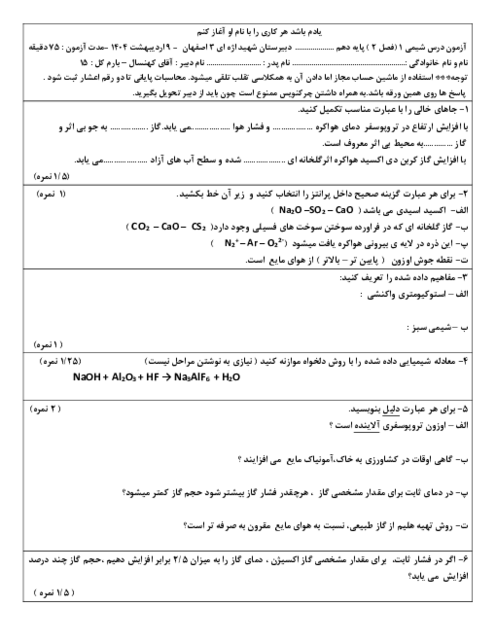
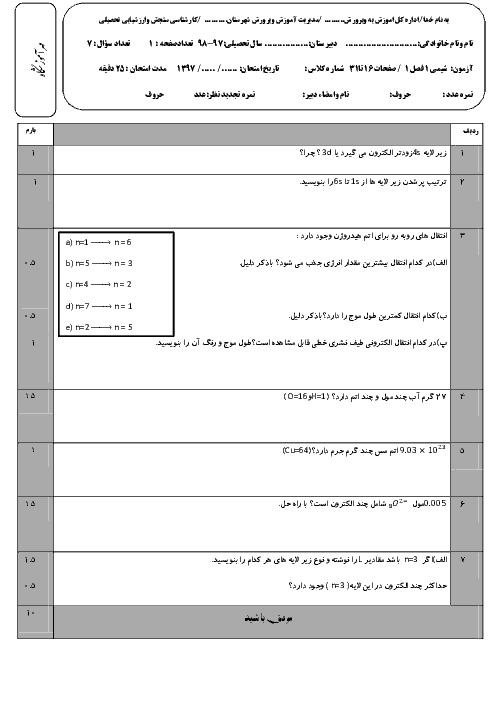
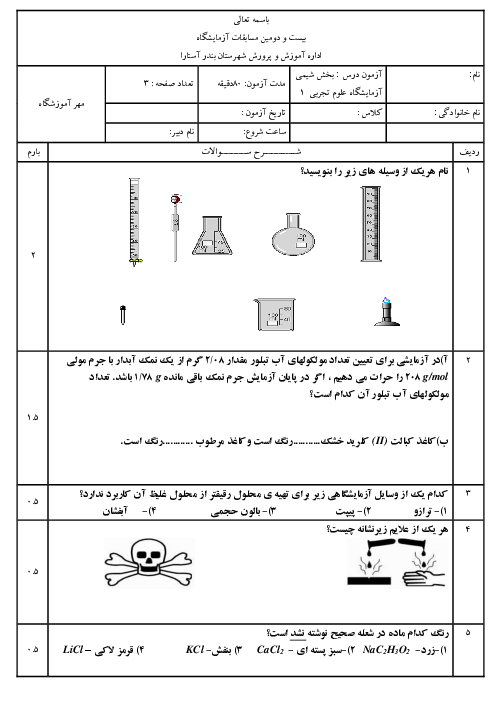
دانش آموزی از منابع علمی، انحلال پذیری (S) پتاسیم کلرید را در آب بر حسب دما (t)، مطابق جدول زیر استخراج کرد. با توجه به آن چه تعداد از عبارتهای زیر درست است؟
* با استفاده از جدول میتوان معادله $S=0/6t+27$ را بیان کرد.
* انحلال پذیری پتاسیم کلرید در آب گرماگیر بوده و با افزایش دما، مقدار ماده حل شده کاهش مییابد.
* تأثیر دما بر انحلال پذیری پتاسیم کلرید بیشتر از سدیم نیترات است.
* در دمای 40 درجه سانتی گراد، با افزودن 39 گرم پتاسیم کلرید به 100 گرم آب، یک محلول سیر شده به دست میآید.
* با کاهش دمای 20 گرم محلول سیر شده این ماده از 60 درجه سانتی گراد به 20 درجه سانتی گراد، بیش از 20 گرم رسوب به دست میآید.
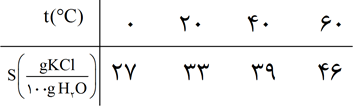
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!