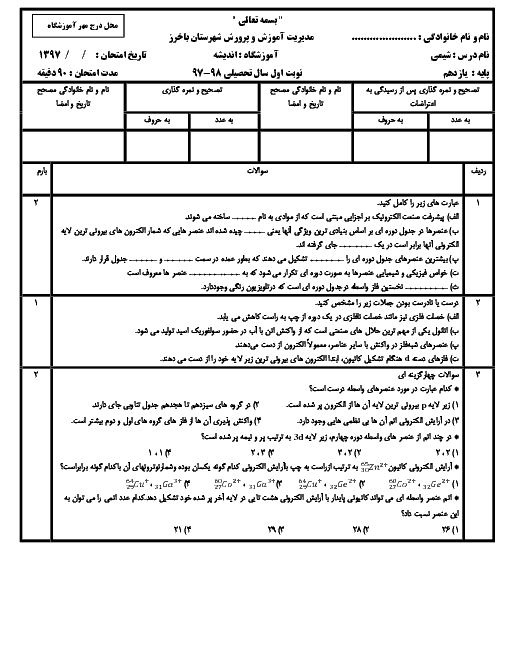
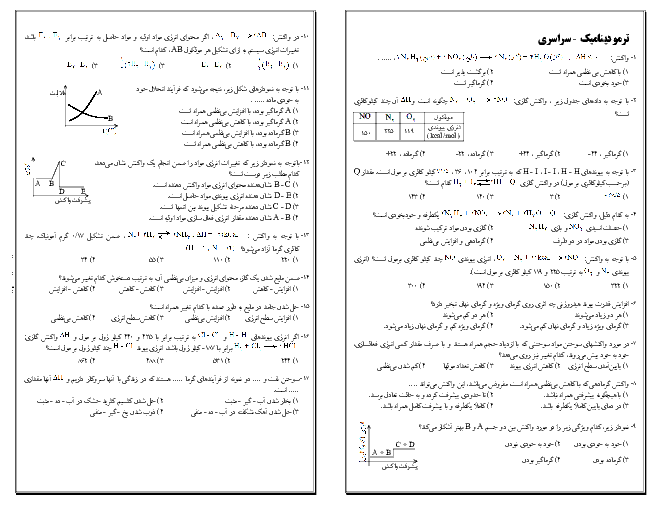
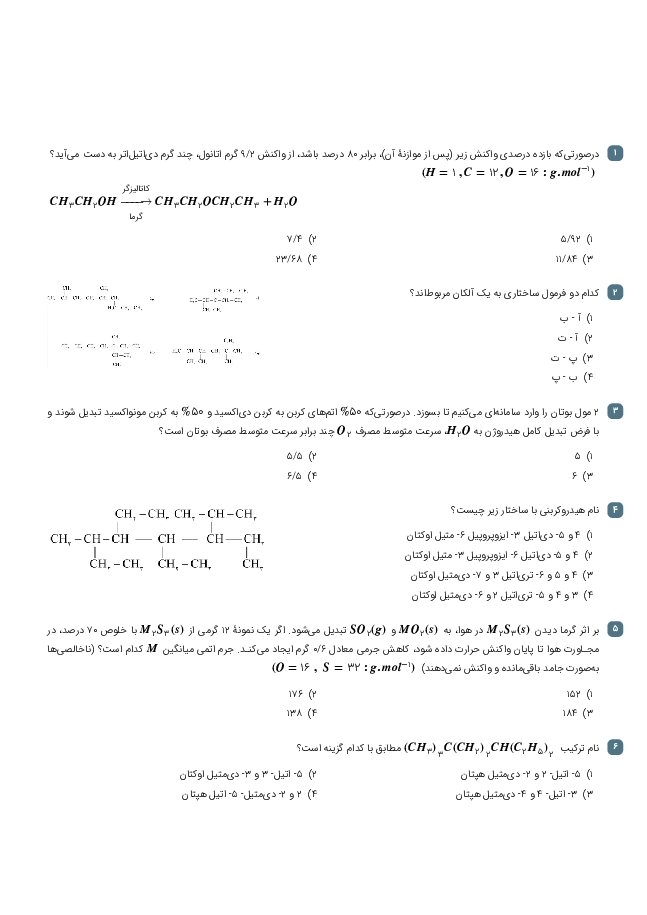
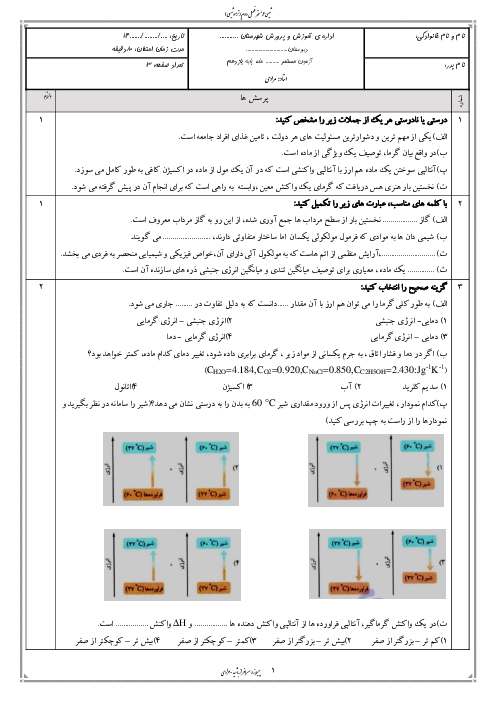
معادلهی واکنش مورد نظر به صورت زیر است:
${{N}_{2}}(g)+3{{H}_{2}}(g)\to 2N{{H}_{3}}(g)$
مطابق معادلهی واکنش، در دما و فشار ثابت، 4 واحد از حجم مخلوط واکنشدهندهها میتوانند 2 واحد حجم فراورده تولید کنند و 2 واحد نیز از حجم آنها کاسته میشود. بنابراین میزان کاهش حجم، معادل حجم فراوردهی تولیدی (آمونیاک) است.
$\overline{R}$ واکنش $=\frac{{{\overline{R}}_{N{{H}_{3}}}}}{2}\Rightarrow 3/84=\frac{{{\overline{R}}_{N{{H}_{3}}}}}{2}\Rightarrow {{\overline{R}}_{N{{H}_{3}}}}=7/68mol.{{\min }^{-1}}$
${{\overline{R}}_{N{{H}_{3}}}}=\frac{\Delta n(N{{H}_{3}})}{\Delta t}\Rightarrow \Delta n(N{{H}_{3}})=7/68\frac{mol}{\min }\times \frac{5}{60}\min =0/64molN{{H}_{3}}$
$d=\frac{m}{v}=\frac{0/64mol\times \frac{17g}{1mol}}{20L}=0/544g.{{L}^{-1}}$