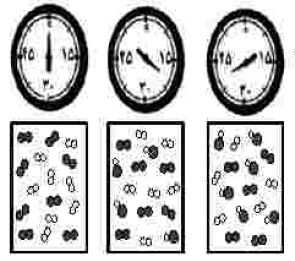
با توجه به شکل زیر، که واکنش ید با هیدروژن را در دمای معیّن در یک ظرف دربستهٔ 2/5 لیتری نشان میدهد، اگر هر ذره ارزش 0/05 حول از هر ماده را نشان دهد، کدام مطلب درست است؟
1 )
سرعت واکنش در 10 دقیقهٔ آغازی، نصف سرعت آن در 20 دقیقهٔ آغازی است؟
سرعت واکنش پس از 40 دقیقه به $1/5 \times {10^{ - 2}}mol.{L^{ - 1}}.{\min ^{ - 1}}$ میرسد.
3 )
سرعت مصرف هیدروژن و تشکیل فراورده، در طول انجام واکنش، برابر است.
4 )
سرعت واکنش در 20 دقیقهٔ آغازی برابر $1/2 \times {10^{ - 4}}mol.{L^{ - 1}}.{s^{ - 1}}$ است.
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!