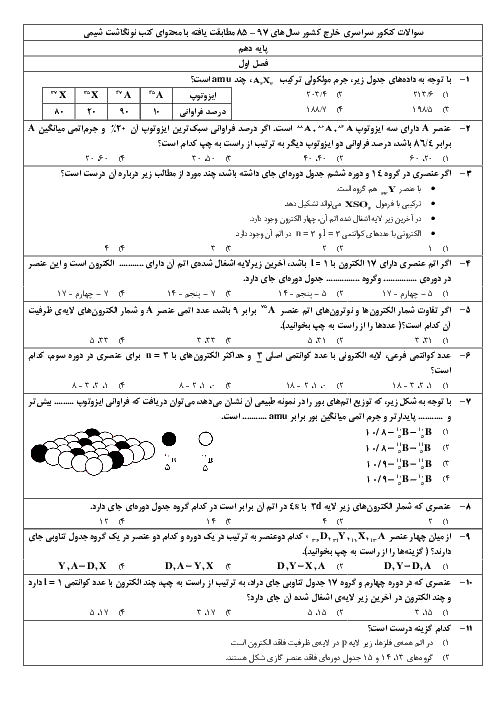
2 لیتر مخلوط گازی دارای $C{{O}_{2}}$ را از درون 50 میلیلیتر محلول 0/005 مولار $Ba{{(OH)}_{2}}$ عبور میدهیم. اگر باقیماندهٔ باز در محلول، با 23/6 میلیلیتر محلول 0/01 مولار $HCl$ خنثی شود، غلظت $C{{O}_{2}}$ در مخلوط گازی، به تقریب چند میلیگرم بر لیتر است؟
($O=16,C=12:g.mo{{l}^{-1}}$، گازهای دیگر مخلوط با باز واکنش نمیدهند.)
$Ba{{(OH)}_{2}}(aq)+C{{O}_{2}}(g)\to BaC{{O}_{3}}(s)+{{H}_{2}}O(l)$
$Ba{{(OH)}_{2}}(aq)+HCl(aq)\to BaC{{l}_{2}}(aq)+{{H}_{2}}O(l)$
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!