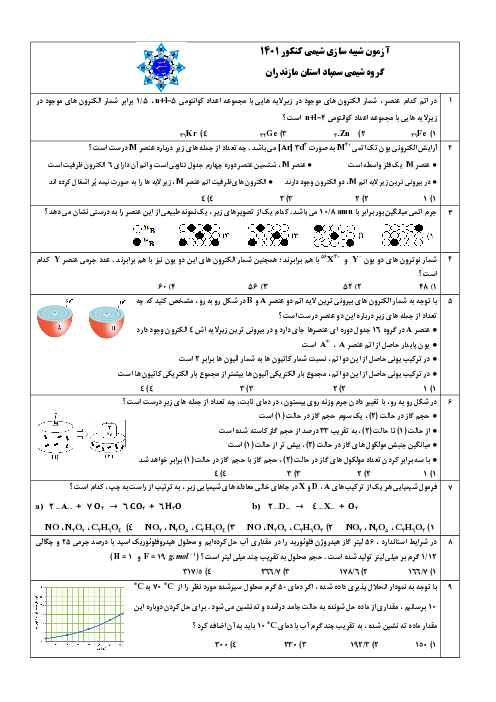
با توجه به معادلههای گرماشیمیایی زیر:
$CaC{l_2}(s) \to C{a^{2 + }}(aq) + 2C{l^ - }(aq),\Delta H = - 83kJ$
$N{H_4}N{O_3}(s) \to NH_4^ + (aq) + NO_3^ - (aq),\Delta H = + 26kJ$
کدام مطلب درست است؟
انحلال مخلوطی به نسبت مولی برابر از این دو ماده در آب، گرماده است.
2 )
از انحلال $N{H_4}N{O_3}(s)$ برای گرم کردن محل آسیبدیدهٔ بدن، استفاده میشود.
3 )
از انحلال 0/2 مول $N{H_4}N{O_3}(s)$ در آب 2/5 کیلوژول انرژی گرمایی با محیط تبادل میشود.
4 )
روند تغییر انحلالپذیری $CaC{l_2}(s)$ در آب نسبت به دما، مشابه انحلالپذیری شمار زیادی از نمکهای دیگر است.
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!