قسمت 4: سامانههای تعادلی و pH محلولها
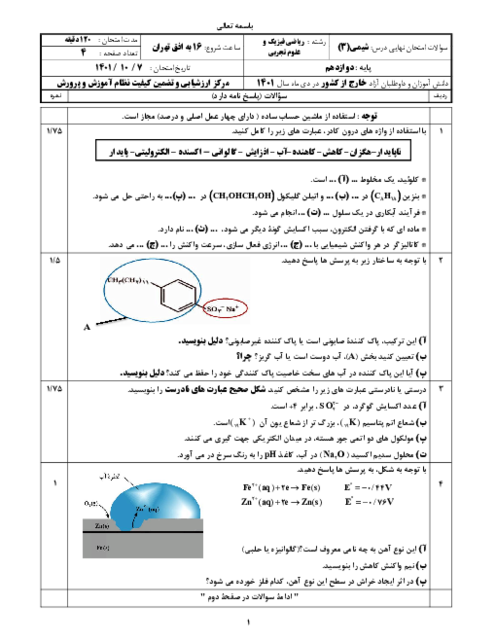
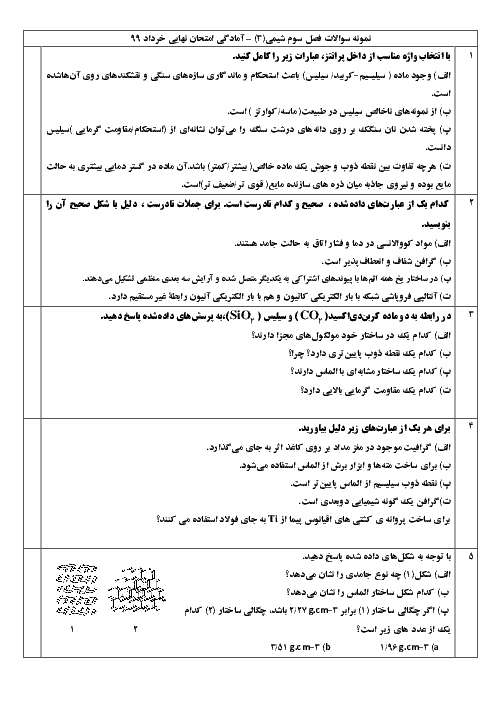
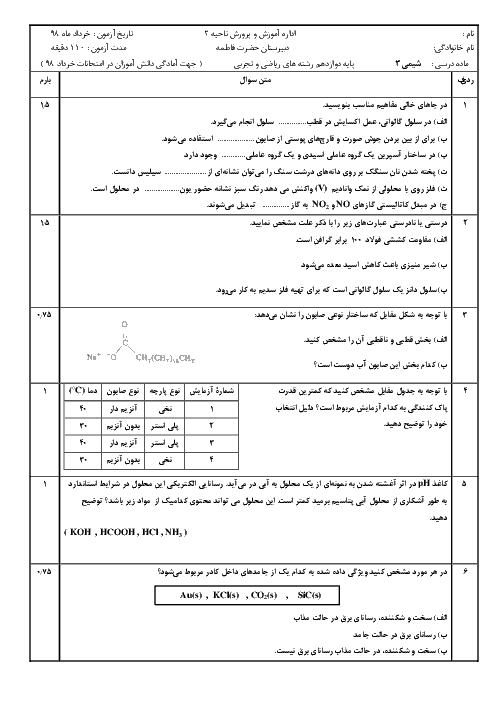
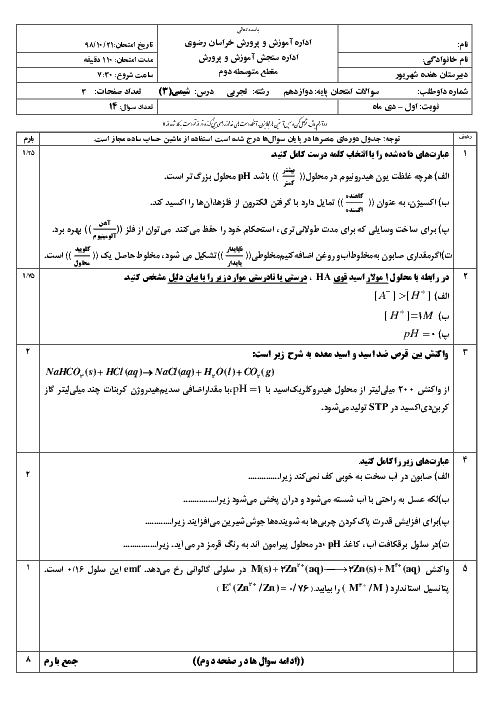
شیمی (3)
دوازدهم
دوره دوم متوسطه- نظری
علوم ریاضی
درسنامه آموزشی این مبحث
در محلولی از اسید HX، غلظت یون هیدرونیوم برابر $2 \times {10^{ - 4}}$ مولار است. چنانچه ثابت یونش این اسید برابر $2 \times {10^{ - 5}}$ باشد، غلظت تعادلی اسید را حساب کنید.
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!