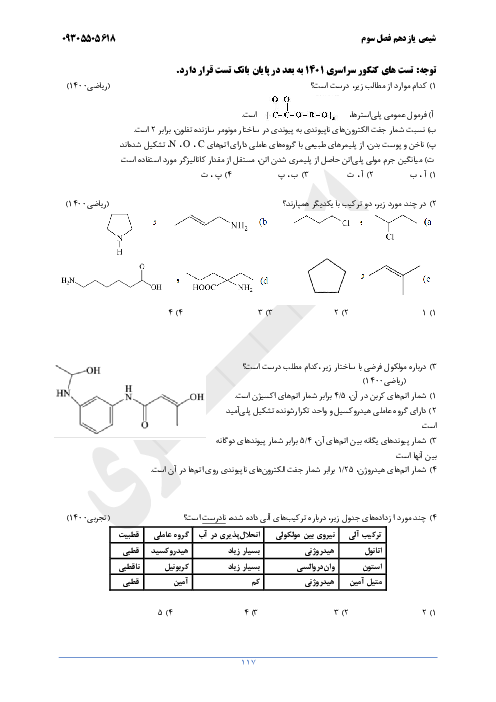
با توجه به واکنشهای زیر به پرسشهای داده شده پاسخ دهید:
$\eqalign{
& (I){N_2}(g) + 3{H_2}(g) \to 2N{H_3}(g) + 92kJ \cr
& (II){N_2}{H_4}(g) + {H_2}(g) \to 2N{H_3}(g) + 183kJ \cr} $
الف) چرا گرمای آزاده شده در دو واکنش متفاوت است؟ (دو دلیل بنویسید.)
ب) در کدام واکنش، مواد واکنش دهنده پایدارتر است؟ چرا؟
پ) به ازای تولید 85 گرم آمونیاک $(N{H_3})$ در واکنش $(II)$، چند کیلوژول گرما آزاد میشود؟ $(N{H_3} = 17g.mo{l^{ - 1}})$
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!