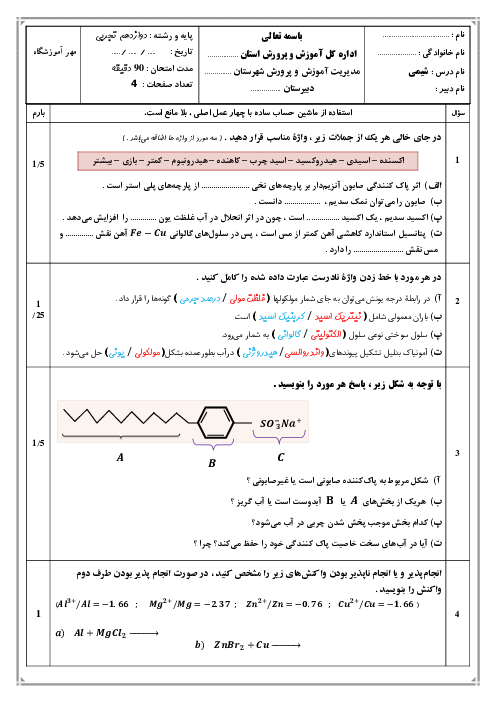
با توجه به جدول داده شده، مشخص میشود که با افزایش دما، $\left[ A \right]$ کاهش و $\left[ B \right]$ افزایش مییابد، بنابراین میتوان نتیجه گرفت که این واکنش در جهت رفت گرماگیر است؛ به بیان دیگر افزایش دما موجب جابهجایی تعادل در جهت رفت شده است که این اتفاق در واکنشهای گرماگیر رخ میدهد:
$aA(g)+Q\rightleftharpoons bB(g)$
از طرفی تغییرات غلظت B ، $\frac{3}{2}$ برابر تغییرات غلظت A است:
$\left. \begin{matrix}
\Delta \left[ A \right]:(0/36-0/44)=-0/08 \\
\Delta \left[ B \right]:(0/72-0/60)=+0/12 \\
\end{matrix} \right\}$
اعداد به دست آمده ضرایب استوکیومتری A و B در معادلۀ موازنۀ موازنه شدۀ واکنش هستند که البته برای اینکه ضریب کسری نداشته باشیم، هر دو عدد را در 2 ضرب میکنیم: $2A(g)+Q\rightleftharpoons 3B(g)$
بررسی گزینهها:
1) این واکنش گرماگیر بوده و با افزایش دما، مقدار ثابت تعادل آن افزایش مییابد:
${{K}_{3}}\gt{{K}_{2}}\gt{{K}_{1}}$
2) عبارت ثابت تعادل این واکنش و مقدار آن در دمای ${{200}^{\circ }}C$ بهصورت زیر محاسبه میشود:
$\begin{align}
& K=\frac{{{\left[ B \right]}^{3}}}{{{\left[ A \right]}^{2}}} \\
& \xrightarrow{t={{200}^{\circ }}C}K=\frac{{{(0/72)}^{3}}}{{{(0/36)}^{2}}}={{(\frac{0/72}{0/36})}^{2}}\times 0/72=2/88mol.{{L}^{-1}} \\
\end{align}$
3) افزایش دما موجب جابهجایی تعادل در جهت مصرف گرما (در جهت رفت) شده که این موضوع تعداد مول گازی را افزایش میدهد. همچنین افزایش دما سرعت واکنشهای رفت و برگشت را افزایش میدهد.
4) کاهش دما، افزایش فشار و افزایش غلظت فراورده بهترتیب موجب جابهجایی تعادل در جهت تولید گرما، مول گازی کمتر و مصرف فرآورده میشود که هر سه مورد نشاندهندۀ چابهجایی تعادل در جهت برگشت است.