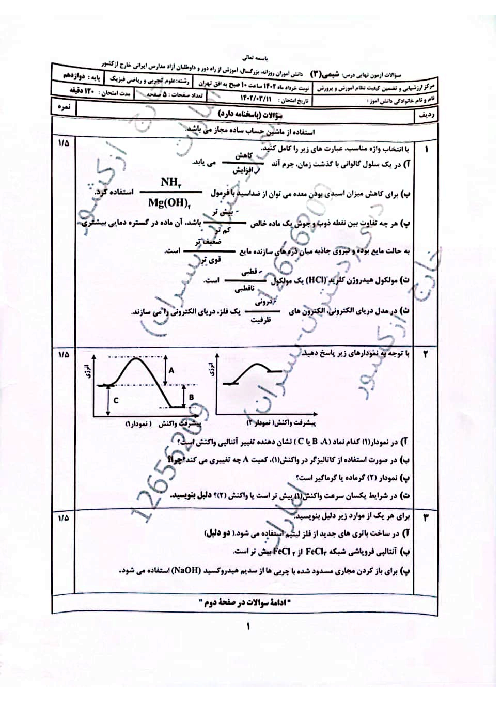
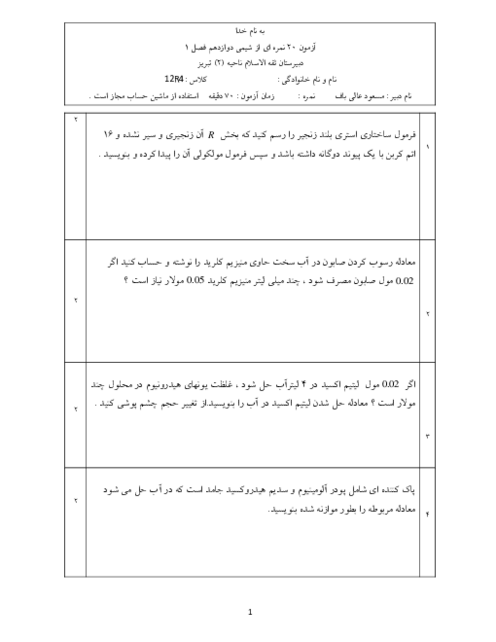
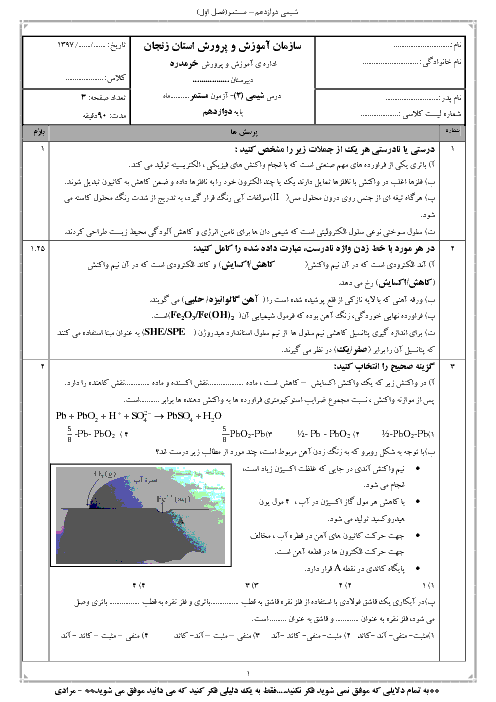
pH محلول 0/1 مولار هیدروسیانیک اسید (HCN) در دمای اتاق با ${K_a} = 4/9 \times {10^{ - 10}}$ را محاسبه کنید. (غلظت تعادلی HCN را به تقریب برابر با غلظت محلول اسید اولیه در نظر بگیرید و ($\log 7 = 0/85$)
$HCN(aq)\;\; \rightleftharpoons \;\;{H^ + }(aq) + C{N^ - }(aq)$
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!