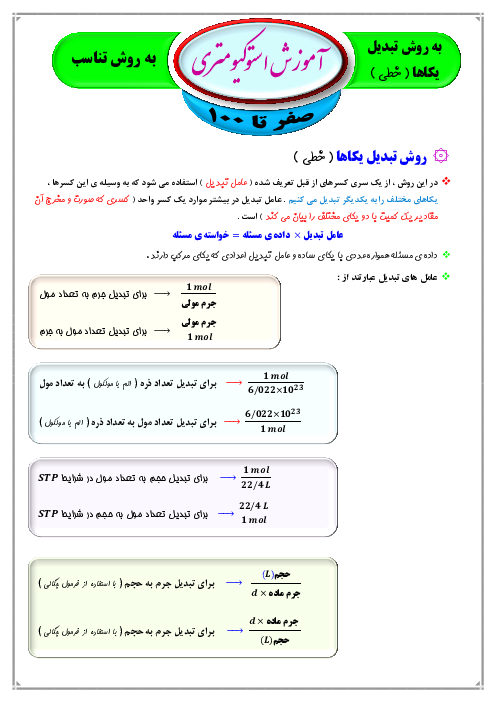
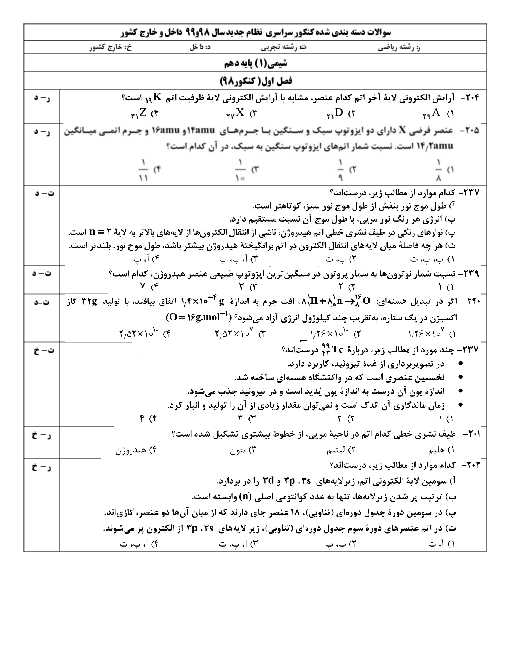
محلول به دست آمده شامل آب و $NaCl$ تولید شده است. بنابراین باید اول جرم این دو ماده را به دست آوریم.
در200 گرم محلول 35/5 درصد جرمی سدیم سولفات، 71 گرم سدیم سولفات و 129 گرم آب وجود دارد:
$N{a_2}S{O_4}:200 \times \frac{{35/5}}{{100}} = 71g$
$ \Rightarrow $ جرم آب $ = 200 - 71 = 129g$
جرم آب که حساب شد. حالا باید ببینیم به ازای مصرف 71 گرم سدیم سولفات چند گرم $NaCl$ و چند گرم $N{a^ + }$ تولید میشود.
اول مول $NaCl$ را حساب میکنیم:
$N{a_2}S{O_4} + CaC{l_2} \to CaS{O_4} + 2NaCl$
$71g\,N{a_2}S{O_4} \times \frac{{1mol\,N{a_2}S{O_4}}}{{142g\,N{a_2}S{O_4}}} \times \frac{{2mol\,NaCl}}{{1mol\,N{a_2}S{O_4}}}$
$ = 1mol\,NaCl = 58/5g\,NaCl$
در 1 مول $NaCl$، امول یا همان 23 گرم $N{a^ + }$ وجود دارد.
جرم کل محلول $ = 129 + 58/5 = 187/5g$
$N{a^ + }$ درصد جرمی $ = \frac{{23}}{{1187/5}} \times 100 \simeq 12/3$